
| A.离子晶体的晶格能:Mg0> KCI> NaCl |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 |
| C.对于反应2H202=2H20+02↑,加入Mn02或升高温度都能加快02的生成速率 |
| D.对羟基苯甲醛的沸点大于邻羟基苯甲醛,原因是后者分子之间存在氢键 |
科目:高中化学 来源:不详 题型:单选题
| A.根据对角线规则,铍和铝的性质具有相似性 |
| B.在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.P4和CH4都是正四面体分子且键角都为109o28ˊ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
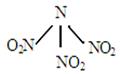
| A.分子中N、O原子间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
| D.分子中四个氮原子围成一个空间正四面体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴、碘单质和CCl4中都含有卤素 |
| B.溴、碘是单质,CCl4是化合物 |
| C.Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水为极性分子 |
| D.以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com