
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
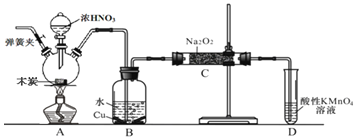
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
【答案】D
【解析】
装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮、二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水;最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
A.若将B中药品换成NaOH溶液,二氧化氮与氢氧化钠反应,没有NO放出,故A错误;
B.因为一氧化氮中混有二氧化碳和水蒸气,二氧化碳和过氧化钠发生反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠和氧气,在B、C装置间增加一个盛放无水![]() 的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
C.由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,实验结束时应先熄灭酒精灯,再停止通入![]() ,可以防止倒吸等意外事故的发生,故C错误;
,可以防止倒吸等意外事故的发生,故C错误;
D.酸性条件下,NO能与![]() 反应生成
反应生成![]() 和
和![]() ,D装置用于尾气处理,标况下,
,D装置用于尾气处理,标况下,![]() LNO的物质的量等于
LNO的物质的量等于![]() mol,根据得失电子守恒,消耗的高锰酸钾为
mol,根据得失电子守恒,消耗的高锰酸钾为![]() mol,故D正确;
mol,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z属于原子序数依次增大的六种短周期主族元素,已知U与X同主族,它们之间的关系如下:
Ⅰ![]() 元素原子的核电荷数:
元素原子的核电荷数:![]()
Ⅱ![]() 可分别和V、W、Y、Z形成具有相同电子数的共价化合物甲、乙、丙、丁
可分别和V、W、Y、Z形成具有相同电子数的共价化合物甲、乙、丙、丁
Ⅲ![]() 、V元素原子的最外层电子数之和与之差分别等于X元素原子的核外电子数与最外层电子数。
、V元素原子的最外层电子数之和与之差分别等于X元素原子的核外电子数与最外层电子数。
请回答下列问题:
![]() 写出下列元素的名称:X______;乙的结构式______。
写出下列元素的名称:X______;乙的结构式______。
![]() 由U、W、X、Y四种元素形成的一种式量为120的物质,溶于水时破坏的是______
由U、W、X、Y四种元素形成的一种式量为120的物质,溶于水时破坏的是______
A.共价键![]() 离子键
离子键![]() 分子间作用力
分子间作用力![]() 氢键
氢键
![]() 、V、W和Y组成一种物质,其原子个数之比为5:1:3:1;该化合物具有还原性。
、V、W和Y组成一种物质,其原子个数之比为5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀NaOH溶液反应的离子方程式:______;
②请设计实验证明该化合物具有还原性:______。
![]() 常用作多彩水泥的添加剂,可用钴的某种氧化物与HZ溶液反应制备
常用作多彩水泥的添加剂,可用钴的某种氧化物与HZ溶液反应制备![]() 其中Co的化合价为
其中Co的化合价为![]() 、
、![]() 。现取适量这种钴的氧化物,可与480mL
。现取适量这种钴的氧化物,可与480mL![]() 溶液恰好完全反应,得到
溶液恰好完全反应,得到![]() 溶液和
溶液和![]() 黄绿色气体
黄绿色气体![]() 标准状况
标准状况![]() 。则该反应的化学反应方程式为______。
。则该反应的化学反应方程式为______。
![]() 由Z元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会在管道周围产生大量白烟,反应的化学方程式为_______。
由Z元素组成的单质戊,化工厂常用浓氨水检验运输戊的管道是否泄漏,如泄漏则会在管道周围产生大量白烟,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1羟胺的酸性溶液与足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.55 mL 0.020 mol·L-1酸性KMnO4溶液完全反应。已知(未配平):FeSO4+KMnO4+H2SO4 → Fe2(SO4)+K2SO4+MnSO4+H2O,则羟胺的氧化产物是
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有Cr2O72-,为了处理有毒的Cr2O72-,需要先测定其浓度:取20 mL废水,加入适量稀硫酸,再加入过量的V1 mL c1 mol·L-1(NH4)2Fe(SO4)2溶液,充分反应(还原产物为Cr3+)。用c2 mol·L-1 KMnO4溶液滴定过量的Fe2+至终点,消耗KMnO4溶液V2 mL。则原废水中c(Cr2O72-)为(用代数式表示)( )
A. ![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 NaOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错 误的是( )
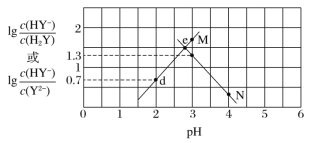
A.曲线 M 表示 pH 与 lgc(HY-)/c(H2Y)的变化关系
B.Ka2(H2Y)=10-4.3
C.d 点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(Na+)
D.交点 e 的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:

已知:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cr(OH)3]=6.4×10-31。
(1)若以氧化物形式表示矿物的组成,则Fe2SiO4可表示为____________。
(2)焙烧时通入氧气的作用是__________________________________________
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43-、AsO43-、SiO32-反应,使其分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。测得反应pH与除杂率的关系如图所示。

①反应过程中控制溶液pH为9,pH>9时除杂率降低的原因是_________。
②反应的温度控制在80 ℃左右,温度不宜太高的主要原因是___________。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)。
①完成“还原”反应的离子方程式:________Cr2O72-+________S2O32-+________===________Cr3++________SO42-+________
②已知铬液中c(Cr2O72-)=0.32 mol·L-1,为了不在还原过程中产生Cr(OH)3沉淀,应控制溶液的pH不大于________。
(5)“沉铬”的主要副产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是![]()
A.![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B.![]() 的沸点高于
的沸点高于![]() ,
,![]() 的沸点也高于
的沸点也高于![]()
C.![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D.![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________。
(3)0.1mol/L的NaHA溶液,测得溶液显酸性。则
①该溶液中c(H2A)________c(A2-)(填“>”、“<”或“=”)
②作出上述判断的依据是_______(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO47H2O。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤、洗涤、干燥得沉淀20g, 滤液质量比原石灰水减少7.6g,该有机物可能是( )
A.乙炔B.乙烷C.乙二醇D.乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com