
| A、H2O、O2 |
| B、CO2、H2 |
| C、CO2、H2O、O2 |
| D、CO2、CO |
| ||
| 1 |
| ||
| 1 |
| ||
| 1 |
| ||
| 1 |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
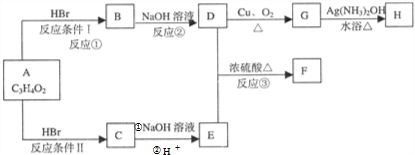
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器中的压强不变 |
| B、2 mol H-O键断裂的同时1 mol H-H键形成 |
| C、c(CO)=c(H2) |
| D、密闭容器的容积不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当加入HA至溶液pH=7时,溶液中的碱还未反应完 |
| B、在滴加HA的过程中,水的电离程度先减小后增加 |
| C、在滴加HA的过程中,溶液中可能存在如下浓度关系:c(A-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| D、反应到达终点时:c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
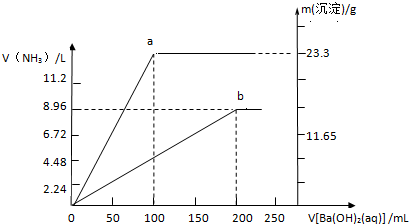
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
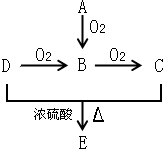 已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.
已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com