
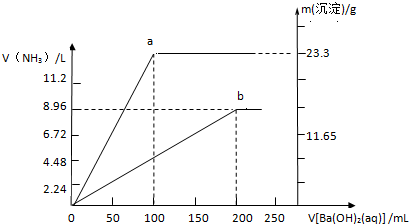
| ||
| V |
| Vm |
| 8.96L |
| 22.4L/mol |
| 23.3g |
| 233g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| n |
| 2 |
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0mol?L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0mol?L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若 ②若 |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1mol?L-1的BaCl2溶液,充分振荡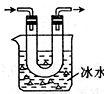 | 结合上述步骤1的有关结论 ①若 ②若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、O2 |
| B、CO2、H2 |
| C、CO2、H2O、O2 |
| D、CO2、CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中 各元素原 子个数比 | A:C= 1:1 | B:C= 1:2 | D:E= 1:3 | B:E= 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.查看答案和解析>>
科目:高中化学 来源: 题型:
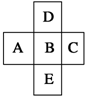 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com