
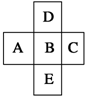
 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
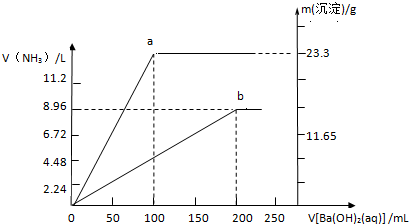
科目:高中化学 来源: 题型:
| V |
| 10 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
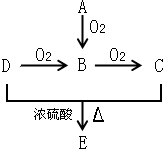 已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.
已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- |
| B、加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- |
| C、某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
| D、某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①加蒸馏水 |
| 溶解,过滤 |
| ②加过量x试剂 |
| 除Mg2+ |
| ③加过量y试剂 |
| 除A离子 |
| ④加过量z试剂 |
| 除()离子 |
| ⑤ |
| 操作甲 |
| ⑥加适量盐酸 |
| 除()离子 |
| ⑦ |
| 蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇在水溶液中电离出少量H+,它的水溶液具有酸性 |
| B、乙醇分子中的氢均可被金属钠置换 |
| C、乙醇跟乙酸反应生成乙酸乙酯,说明乙醇具有碱性 |
| D、在一定条件下,乙醇能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com