
| A、加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- |
| B、加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- |
| C、某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
| D、某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
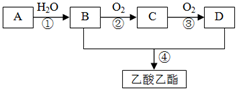 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
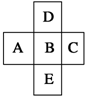 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 740 | 1500 | 7700 | 10500 |
| F | 580 | 1800 | 2700 | 11600 |
| G | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com