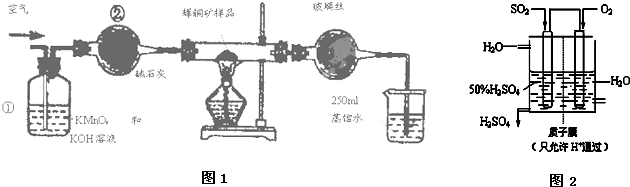
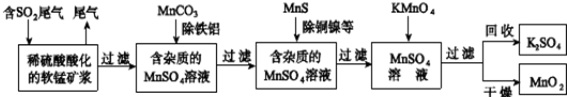
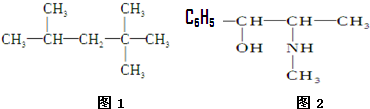考点:位置结构性质的相互关系应用,化学键,共价键的形成及共价键的主要类型,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E、F六种短周期元素,核电荷数依次增加,B原子最外层电子数是内层电子数的2倍,最外层电子数不超过8个,K层为最外层不超过2个,则B内层为K层,所以B是C元素;
B与F同主族,且为短周期元素,则F是Si元素;
E原子序数大于B而小于F,E为金属,E
+与C
3-具有相同的电子层结构,则E为Na元素,C原子序数小于E,所以C为N元素;D最外层有两对成对电子,且原子序数小于Na,则D为O元素;
A与E同主族,且这几种元素中只有E是金属,则A是H元素,
(1)F为Si元素,Si原子的3s、3p电子为其价电子;B是C元素、F是Si元素,二者形成化合物SiC,该化合物的构成微粒是原子;
(2)H、C、N、O形成的既有离子键又有共价键的化合物为碳酸氢铵或碳酸铵等;
(3)H、N形简单分子为NH
3,氨气分子中含有一个孤电子对、3个σ键,中心原子价层电子对个数是4;
(4)元素的非金属性越强,其气态氢化物越稳定;电子层结构相同的离子,其离子半径随着原子序数增大而减小;
(5)金刚石晶胞中C原子个数=4+8×
+6×
=8,晶体硅与金刚石的晶胞结构相似,所以晶体硅最致密晶体的晶胞中Si原子个数为8,设其晶胞体积为V,密度ρ=
=
,某晶体硅的密度是其最致密晶体密度的
,则该晶体硅的密度=
×
=
,根据其密度中原子个数判断空穴个数.
解答:
解:A、B、C、D、E、F六种短周期元素,核电荷数依次增加,B原子最外层电子数是内层电子数的2倍,最外层电子数不超过8个,K层为最外层不超过2个,则B内层为K层,所以B是C元素;
B与F同主族,且为短周期元素,则F是Si元素;
E原子序数大于B而小于F,E为金属,E
+与C
3-具有相同的电子层结构,则E为Na元素,C原子序数小于E,所以C为N元素;D最外层有两对成对电子,且原子序数小于Na,则D为O元素;
A与E同主族,且这几种元素中只有E是金属,则A是H元素,
(1)F为Si元素,Si原子的3s、3p电子为其价电子,所以其价电子排布式为3s
23p
2 ;B是C元素、F是Si元素,二者形成化合物SiC,该化合物的构成微粒是原子,所以属于原子晶体,
故答案为:3s
23p
2 ;原子晶体;
(2)H、C、N、O形成的既有离子键又有共价键的化合物为碳酸氢铵或碳酸铵等,其化学式为NH
4HCO
3或(NH
4)
2CO
3,
故答案为:NH
4HCO
3或(NH
4)
2CO
3;
(3)H、N形简单分子为NH
3,氨气分子中含有一个孤电子对、3个σ键,中心原子价层电子对个数是4,所以N原子杂化方式为sp
3,故答案为:1;3;sp
3;
(4)C是N元素、F是Si元素,非金属性N>Si,所以气态氢化物的稳定性NH
3>SiH
4;电子层结构相同的离子,其离子半径随着原子序数增大而减小,E
+、C
3-的电子层结构相同,且E原子序数大于C,所以离子半径E
+<C
3-,
故答案为:NH
3>SiH
4;<;
(5)金刚石晶胞中C原子个数=4+8×
+6×
=8,晶体硅与金刚石的晶胞结构相似,所以晶体硅最致密晶体的晶胞中Si原子个数为8,设其晶胞体积为V,密度ρ=
=
,某晶体硅的密度是其最致密晶体密度的
,则该晶体硅的密度=
×
=
,根据其密度知,该晶胞中Si原子个数是6,所以该晶体晶胞中最多有2个“空穴”,故答案为:2.
点评:本题考查较综合,涉及晶胞计算、原子杂化、晶体类型判断、核外电子排布等知识点,这些知识点都是高考高频点,熟练掌握基本公式、基本理论即可解答,难点是晶胞计算,会利用均摊法计算原子个数,题目难度中等.



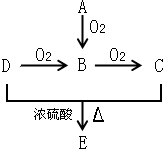 已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.
已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.