
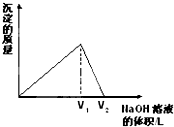
 向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )
向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )A、
| ||
B、
| ||
C、
| ||
D、
|
| 1 |
| 3 |
| 1 |
| 4 |
| 1 |
| 4 |
| n |
| V |
| 1 |
| 3 |
| n |
| V |
| ||
| aL |
| CV1 |
| 3a |
| 1 |
| 4 |
| 1 |
| 4 |
| n |
| V |
| ||
| a |
| V2C |
| 4a |
| n |
| V |
| V2-V1 |
| a |


科目:高中化学 来源: 题型:
| A、浓度为1mol/L的Al2(SO4)3溶液中Al3+的数目为2NA |
| B、室温下,21.0g乙烯和丁烯(C4H8)的混合气体中含有的碳原子数目为1.5NA |
| C、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D、标准状况下,22.4L乙醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入浓硫酸后再小心常压蒸馏 |
| B、各仪器连接处的橡皮塞应塞紧防止漏气 |
| C、加入浓硫酸后再减压蒸馏 |
| D、加入浓硫酸后再加压蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中可以得到NaCl,电解熔融NaCl可制备金属Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水的淡化,只需经过化学变化就可以得到 |
| D、利用海水、铝、空气的航标灯的原理是将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室模拟煤的干馏的实验装置,下列有关叙不正确的是( )
如图是实验室模拟煤的干馏的实验装置,下列有关叙不正确的是( )| A、图示实验中发生了化学反应 |
| B、实验后水溶液的pH>7,溶液Y是黑色黏稠的煤焦油,上层X是粗苯等 |
| C、气体Z中有些成分易燃,且可以还原氧化铜 |
| D、液体Y是一种纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com