碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
(1)保存碘单质时应注意的问题是
.
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子:
①I
2(aq)+I
-(aq)?I
3-(aq)△H<0 ②I
2(aq)+2I
-(aq)?I
42-(aq)反应②的平衡常数K=
(填表达式).温度升高时,反应①的平衡常数将
(填“增大”不变”或“减小”).
(3)碘与钨在一定温度下,可发生如下的可逆反应:W(s)+I
2(g)?WI
2(g).现准确称取0.508g碘、0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应.如图是混合气体中的WI
2蒸气的物质的量随时间变化关系的图象[n(WI
2)-t],其中曲线I(0~t
2时间段)的反应温度为450℃,曲线Ⅱ(从t
2时刻开始)的反应温度为530℃.
①该反应△H
0(填“>”或“<”).
②反应从开始到t
1(t
1=3min)时间内的平均速率υ(I
2)=
.
③在450℃时,该反应的平衡常数K=
.
④能够说明上述反应已经达到平衡状态的有
.
A.I
2与WI
2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
(4)I
2O
5是白色粉末状固体,可用作氧化剂使H
2S、CO、HCl等被氧化,在合成氨工业中常用I
2O
5来定量测量CO的含量.已知:
①2I
2(s)+5O
2(g)=2I
2O
5(s)△H=-75.56kJ?mol
-1②2CO(g)+O
2(g)=2CO
2(g)△H=-566.0kJ?mol
-1写出CO(g)与I
2O
5(s)反应析出固态I
2的热化学方程式:
.

 碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:

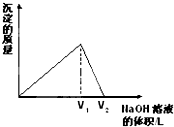 向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )
向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )