
| A、钠的化合物 | B、可与盐酸反应 |
| C、可溶于水 | D、电解质 |
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 最高价氧化物对应的水化物和气态氢化物可以发生化合反应 | 原子的M层有1对成对的p电子 | 原子核外有5种能量不同的电子,最外层电子为7 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度为1mol/L的Al2(SO4)3溶液中Al3+的数目为2NA |
| B、室温下,21.0g乙烯和丁烯(C4H8)的混合气体中含有的碳原子数目为1.5NA |
| C、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D、标准状况下,22.4L乙醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.12L氦气所含原子数为0.1NA |
| B、1.6gNH2-离子所含质子数为NA |
| C、22.4LHCI溶于水,溶液中H数为NA |
| D、9gD2O所含的中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银氨溶液中加入足量盐酸产生沉淀:[Ag(NH3)2]-+OH-+3H++Cl-=AgCl↓+2 NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:3BaS03+2 H++2 NO3-=3BaS04↓+2NO↑+H20 |
| C、碳酸钠溶液中通入少量S02:2CO32-+SO2+H2O=2HCO3-+SO32- |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2=CH2+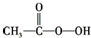 (过氧乙酸)→ (过氧乙酸)→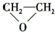 +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→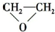 +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
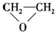 | ||
D、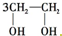
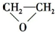 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入浓硫酸后再小心常压蒸馏 |
| B、各仪器连接处的橡皮塞应塞紧防止漏气 |
| C、加入浓硫酸后再减压蒸馏 |
| D、加入浓硫酸后再加压蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com