
(17分)某同学受2Mg+CO2  2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。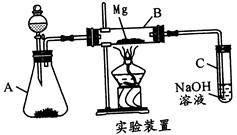
(1)选择制取SO2的合适试剂:_____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:____________
(3)有同学认为本实验应在镁下方垫一不锈钢片,理由是______________
(4)你认为该装置是否有不足之处?__________如果有,请列出两点:_________、________。
(5)对于反应后试管C中的成份某同学提出如下假设:
假设①全部是NaSO3 假设②全部是NaHSO3
假设③_____________________ 假设④_____________________
请补充完善假设。并将下表实验检验设计及结论补充完整。
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH | 若PH>7 | 证明__________正确 |
| 若PH=7 若PH<7 | 证明__________正确 证明__________正确 |
(1)②③(1分)
(2)3Mg+SO2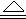 2MgO+MgS (2Mg+2SO2
2MgO+MgS (2Mg+2SO2 2MgO+S Mg+S
2MgO+S Mg+S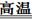 Mgs) (2分)
Mgs) (2分)
(3)SiO2是酸性氧化物 所以Mg与玻璃中的SiO2能发生反应,故不能直接接触(2分)
(4)有(1分) 在A与B之间未连接一干燥装置;C装置未与大气相通
未放设计防倒吸装置(写两点即可)(2分)
(5)Na2SO3和NaHSO3的混合物 (1分) NaSO3和NaOH的混合物(1分)
假设①正确。(2分)
若 PH > 7 则溶液是Na2SO3和NaOH的混合物(1分)
PH < 7 则说明是NaHSO3的Na2SO3的混合物(1分)
PH=7 则说明是Na2SO3(1分)
解析


科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变血红色 溶液变血红色 |
固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
查看答案和解析>>
科目:高中化学 来源:2012年山西省高考理综模拟试题(三)理科综合化学试卷(解析版) 题型:实验题
(17分)某同学受2Mg+CO2
 2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。

(1)选择制取SO2的合适试剂:_____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:____________
(3)有同学认为本实验应在镁下方垫一不锈钢片,理由是______________
(4)你认为该装置是否有不足之处?__________如果有,请列出两点:_________、________。
(5)对于反应后试管C中的成份某同学提出如下假设:
假设① 全部是NaSO3 假设②全部是NaHSO3
假设③_____________________ 假设④_____________________
请补充完善假设。并将下表实验检验设计及结论补充完整。
|
实验操作 |
预期现象 |
结论 |
|
(1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 |
无白色沉淀产生 |
证明假设_______是正确的 |
|
(2)若有白色沉淀产生再检测(1)的上层溶液的PH |
若PH>7 |
证明__________正确 |
|
若PH=7 若PH<7 |
证明__________正确 证明__________正确 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省长沙市雅礼中学高三(上)月考化学试卷(9月份)(解析版) 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com