
有关C2H6、C2H4、C2H2之叙述正确的是
A.C原子的轨道杂化类型分别为sp、sp2、sp3
B.π键总数:C2H6>C2H4>C2H2
C.σ键总数:C2H6>C2H4>C2H2
D.碳碳键间的键能:C2H6>C2H4>C2H2
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
某物质A在一定条件下加热完全分解,产物都是气体,分解方程式为:2A=B+C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
A.7d B.4d C.2.5d D.2d
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子不一定等于2NA
B.1molNa2O2晶体中共含有4NA个离子
C.1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA
D.常温下pH=1的H2SO4溶液中,H+的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:填空题
(10分)某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、SO42-、OH-离子中的一种或几种,现通过下实验进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,
(3)像上述溶液中加入BaCl2溶液,无现象。
据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 ,依次写出(2)中加入氢氧化钠后的离子反应: , 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
下列各物质的分类、名称(或俗名)、化学式都正确的是
A.金属氧化物 氧化铁 FeO
B.非金属氧化物 二氧化硫 SO2
C.含氧酸 硫酸 H2SO3
D.碱 纯碱 Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
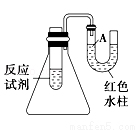
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 ,试管中观察到的现象是
(2)U形导管中液面A (填“上升”或“下降”),原因是 ,说明此反应是 (填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:填空题
(10分)自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
时间(s) | 0 | 10 | 20 | 25 | 30 |
条件A [n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
条件B [n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各组离子中,在给定条件下能够大量共存的是
A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32-
B.无色溶液中:Mg2+、MnO4-、SO42-、K+
C.酸性溶液中可能大量存在Na+、ClO?、SO42?、I?
D.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:填空题
(17分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
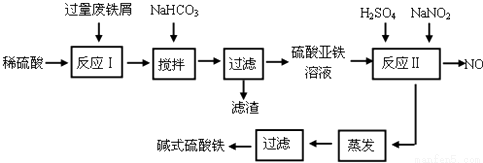
回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法_____________________。
(2)加入少量NaHCO3的目的是调节pH在_________________范围内。
(3)反应Ⅱ中加入NaNO2的目的是__________________。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为_________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_______________。
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素总含量为g/L。若滴定前溶液中H2O2没除尽,所测定的铁元素的含量将会____________(填“偏高”“偏低”“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com