
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
分析 X、Y、Z、M、R、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y有+4、-4价,是无机非金属材料的主角,则Y为Si;Z焰色反应呈黄色,则Z为Na;M只有-2价,则为O元素;R有+7、-1价,则R为Cl;Q有+3,原子半径大于Cl,则Q为Al,
(1)R为Cl,位于第三周期第ⅦA族;R在自然界中有质量数为35和37的两种核素,质子数相同,中子数不同;
(2)钠与水反应生成NaOH和氢气;
(3)非金属性Cl>Si,可利用氢化物的稳定性、最高价氧化物对应的水化物的酸性、得电子能力等比较;
(4)同周期从左向右原子半径减小,同主族从上到下原子半径增大;
(5)NaOH和氢氧化铝反应生成偏铝酸钠和水(或NaOH与硅酸反应、NaOH与高氯酸反应).
解答 解:X、Y、Z、M、R、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y有+4、-4价,是无机非金属材料的主角,则Y为Si;Z焰色反应呈黄色,则Z为Na;M只有-2价,则为O元素;R有+7、-1价,则R为Cl;Q有+3,原子半径大于Cl,则Q为Al,
(1)R为Cl,位于第三周期第ⅦA族;R在自然界中有质量数为35和37的两种核素,质子数相同,中子数不同,二者互为同位素,
故答案为:第三周期第ⅦA族;互为同位素;
(2)Z的单质与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑,故答案为:2Na+2H2O═2NaOH+H2↑;
(3)Y与R相比,非金属性较强的是Cl,
a.常温下Y的单质呈固态,R的单质呈气态,非金属性与状态无关,故a不选;
b.稳定性:XR>YX4,可知非金属性R的强,故b选;
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3,可知非金属性R的强,故c选;
故答案为:Cl;bc;
(4)同周期从左向右原子半径减小,同主族从上到下原子半径增大,则0.099nm<rY<0.143nm,故答案为:0.099;0.143;
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙+水,则丙的化学式为NaAlO2(Na2SiO3或NaClO4),故答案为:NaAlO2(Na2SiO3或NaClO4).
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质推断元素、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
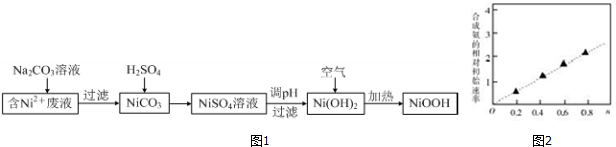
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 实验过程 | 实验用品 |
| I | 将干海带灼烧灰化 | 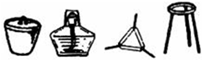 |
| II | 将海带灰溶解、过滤 | 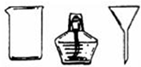 和①玻璃棒 和①玻璃棒 |
| III | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O | 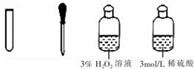 |
| IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | 818O2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al2O3(熔融) $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| C. | Fe+CuSO4=FeSO4+Cu | |
| D. | 2NaCl(水溶液)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com