
【题目】如图是一个电化学过程的示意图,回答下列问题:
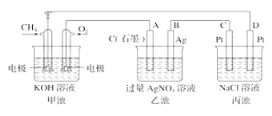
(1)甲池将__________能转化为__________能,乙装置中电极A是__________极。
(2)甲装置中通入CH4一极的电极反应式为 __________
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入__________(写化学式)。
【答案】 化学 电 阳 CH4+10OH - - 8e- = CO32- +7H2O 12 HCl
【解析】(1)甲池为甲烷形成的燃料电池;根据原电池的正负极判断电解池的阴阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根;
(3)电解氯化钠溶液时,阴极上氢离子放电,阳极上氯离子放电,根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH;根据电解的产物分析,根据“析出什么元素加入什么元素”的原则确定加入的物质。
(1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,原电池是将化学能转化为电能的装置;通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A为阳极,故答案为:化学;电;阳;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(3)设电解后氢氧化钠的物质的量浓度是x,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56mL,即0.056L,
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH,
22.4L 2mol
0.056L x×0.5L
则x=![]() =0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。
=0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。


科目:高中化学 来源: 题型:
【题目】利用如图装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )

A. 铜与稀盐酸B. 碳酸氢钠与氢氧化钠溶液
C. 碳酸钙与稀硫酸D. 碳酸氢铵与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度不变
D.向AgCl沉淀中加入NaCl固体,AgCl的沉淀溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 粗铜精炼时与电源正极相连的是纯铜,主要电极反应式:Cu-2e-=Cu2+
C. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-![]() Fe3+
Fe3+
D. 钢闸门应与外接电源的负极相连,起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
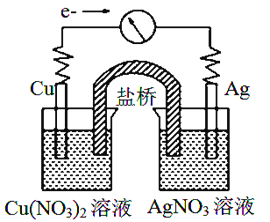
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 工作一段时间后,AgNO3溶液中c(Ag+)减小
C. 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D. Cu作负极,发生还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
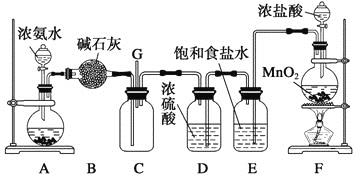
(1)装置A中的烧瓶内固体不可以选用___________________(选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F中发生反应的化学方程式是_____________________________________________。
(3)B装置的作用__________________;E装置的作用__________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__________________________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为_____________mol-1 (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
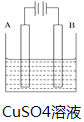
(1)A电极对应的金属是______________(写元素名称),B电极发生__________(氧化或还原)反应,电极反应式是__________________
(2)镀层破损后,镀铜铁比镀锌铁更_____________被腐蚀(填“容易”“不容易”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式___________________________________________。
(2)装置C中的试剂是______________;装置F的作用是_____________________________;
装置E中的h瓶需要冷却的理由是_____________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:______________。
②滴定前是否要滴加指示剂?_____(填“是”或“否”),请说明理由___________________。
③滴定前检验Fe3+是否被完全还原的实验操作是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com