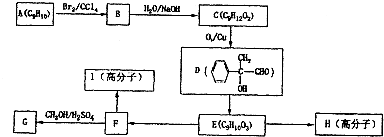
���
�⣺��1���ڵ�������������Nԭ�ӹ������Ե��ӣ�����N
2�ĵ���ʽΪ��
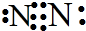
��
������1g���ų�����a kJ��2mol����������Ϊ��17g/mol��2mol=43g��������2mol�����ų�������Ϊ34g����ϳɰ������Ȼ�ѧ����ʽΪ��N
2��g��+3H
2 ��g��?2NH
3 ��g����H=-34akJ/mol��
�ʴ�Ϊ��
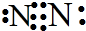
��N
2��g��+3H
2 ��g��?2NH
3 ��g����H=-34akJ/mol��
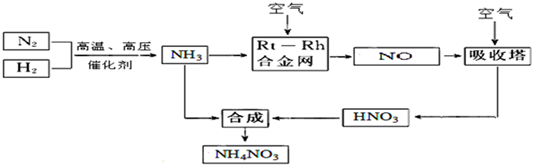
��2�����ڴ������汻����ΪNO���ô������Ļ�ѧ����ʽΪ��4NH
3+5O
24 NO+6H
2O��
���ںϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�����Դ�ƽ��Ƕȿ�������������߷�Ӧ���ת���ʣ�����Ӧ���ʹ������ʺϳɰ����ø��£�400��-500�棩��
����Ӧ�����С������ѹǿ���������ת���ʣ������ƶ������ʲ��ø�ѹ��10 MPa-30MPa����
�ʴ�Ϊ��4NH
3+5O
24 NO+6H
2O���ϳɰ�����Ӧ���ȣ��������������ת���ʣ�����Ӧ���ʹ������ʺϳɰ����ø��£�400��-500�棩������Ӧ�����С������ѹǿ���������ת���ʣ������ƶ������ʲ��ø�ѹ��10 MPa-30MPa����
��3��������NH
3�Ĺܵ�ij������й©�����ļ���������ʪ�ĺ�ɫʯ����ֽ��⣬��ֽ������λ�ü��ǰ���й©��������պ��Ũ����IJ������������а��̲�����
�ʴ�Ϊ������ʪ�ĺ�ɫʯ����ֽ��⣻��ֽ������λ�ü��ǰ���й©����
��4��ũҵ�����ϳ��ڡ�����ʹ�û�������泥�����������ữ��������Ϊ�������ǿ�������Σ����λᷢ��ˮ�ⷴӦ��NH
4++H
2O?NH
3?H
2O+H
+��������ˮ���������OH
-���ƻ���ˮ�Ĵ���ƽ�⣬ˮ��������룬�����մﵽ����ƽ��ʱc��H
+����c��OH
-����������Һ�����ԣ�
�ʴ�Ϊ��NH
4++H
2O?NH
3?H
2O+H
+��
��5��25��ʱ����x mol NH
4NO
3����һ����ˮ�У������Һ�еμ�y L��ˮ����ˮ�������笠����Ӻ�OH
-�����ˮ�ĵ������������ã����ԵμӰ�ˮ������ˮ�ĵ���ƽ�⽫�����ƶ���
�ڸ���Һ�У����ڵ���غ㣺c��NH
4+��+��H
+��=c��NO
3-��+c��OH
-����������ҺΪ���ԣ���H
+��=c��OH
-��������c��NH
4+��=c��NO
3-��������K
b��NH
3?H
2O��=2.0��10
-5mol/L������K
b=
=2.0��10
-5mol/L��
�����İ�ˮ���ʵ���Ϊn�����Һ���ΪV������c��NH
4+��=c��NO
3-�����൱����Һ�е�һˮ�ϰ���ȫ���Եμӵİ�ˮ��
��c��NH
3?H
2O��=
=
=
��
��ã�n��NH
3?H
2O��=
mol��
���Եμӵİ�ˮ��Ũ��Ϊ��c����NH
3?H
2O��=
=
mol/L��
�ʴ�Ϊ������
mol/L��

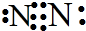 ��
��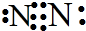 ��N2��g��+3H2 ��g��?2NH3 ��g����H=-34akJ/mol��
��N2��g��+3H2 ��g��?2NH3 ��g����H=-34akJ/mol��

 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�