


分析 印刷电路板的废液中含有大量的CuCl2、FeCl2和FeCl3,加入过量铁粉,三价铁离子先转化成二价铁离子,铜离子被还原成铜单质,充分反应后,过滤得到铜和滤液,滤液中主要成分是氯化亚铁,通入强氧化剂氯气将其氧化成氯化铁,据此分析.
(1)铜不溶于水溶液,采用过滤操作可分离FeCl2溶液和铜,获得的铜粉中含有杂质Fe,可利用酸溶或铜盐溶液置换;
(2)KClO3与浓HCl常温下反应生成氯气、氯化钾、水,以此写出反应物、产物并配平;
(3)氯气通入氯化亚铁溶液反应,剩余的氯气不能排放空气中需要尾气吸收装置;氯气具有强氧化性,氯化亚铁溶液通入氯气得到三氯化铁溶液,因此改写为离子方程式;
(4)Fe2+能使铁氰化钾溶液变蓝.
解答 解:印刷电路板的废液中含有大量的CuCl2、FeCl2和FeCl3,加入过量铁粉,三价铁离子先转化成二价铁离子,铜离子被还原成铜单质,充分反应后,过滤得到铜和滤液,滤液中主要成分是氯化亚铁,通入强氧化剂氯气将其氧化成氯化铁.
(1)铜不溶于水溶液,采用过滤操作可分离FeCl2溶液和铜,获得的铜粉中含有杂质Fe,可利用酸溶或铜盐溶液置换,因此除杂所需的试剂是 HCl或H2SO4或CuCl2或CuSO4,
故答案为:过滤;HCl或H2SO4或CuCl2或CuSO4;
(2)KClO3与浓HCl常温下反应生成氯气、氯化钾、水,化学方程式KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,
故答案为:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O;
(3)制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置需要把氯气通入氯化亚铁溶液中发生反应生成氯化铁,氯气有毒需要尾气吸收,据此设计选择装置为: ;
;
氯气具有强氧化性,氯化亚铁溶液通入氯气得到三氯化铁溶液,其反应的化学方程式为:2FeCl2+C12=2FeCl3,离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+,
故答案为: ;Cl2+2Fe2+=2Cl-+2Fe3+;
;Cl2+2Fe2+=2Cl-+2Fe3+;
(4)Fe2+能使铁氰化钾溶液变蓝,向待测液滴2滴铁氰化钾溶液,若变蓝,说明还有Fe2+,若不变蓝,说明没有Fe2+.
故答案为:向待测液滴2滴铁氰化钾溶液,若变蓝,说明还有Fe2+,若不变蓝,说明没有Fe2+.
点评 本题考查了物质制备的实验方案设计和实验过程分析,物质性质的熟练掌握是解题关键,注意离子的检验方法,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
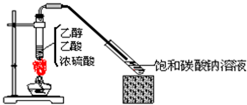 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是| A. | 石蕊层仍为紫色,有机层无色 | |
| B. | 石蕊层有两层,上层为紫色,下层为蓝色 | |
| C. | 石蕊层为三层环,由上而下是红、紫、蓝 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有7个中子的碳原子:${\;}_6^{13}C$ | |
| B. | HF的电子式: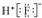 | |
| C. | CH4分子的球棍模型: | |
| D. | Cl-离子的结构示意图: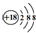 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB3 | B. | AB | C. | A3B | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | 只有① | C. | ①和② | D. | 都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com