




科目:高中化学 来源:不详 题型:单选题

A.含有大量S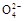 的溶液中肯定不存在Ag+ 的溶液中肯定不存在Ag+ |
| B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.在该温度下,MgCO3、MnCO3的溶解度依次增大 |
| B.d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL蒸馏水 | B.100mL 0.2mol·L-1 AgNO3 |
| C.100 mL 0.1mol·L-1AlCl3 | D.100mL 0.1 mol·L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a点表示c(Ag+)=c(CrO42—) |
| B.b点可表示AgI的饱和溶液 |
| C.该温度下AgI的Ksp约为1×10—16 |
| D.该温度下AgCl、AgBr饱和溶液中:c(Cl—)<c(Br—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
| C.c(Mg2+)为0.11 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com