
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是____。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。
【答案】D D 2Na+O2![]() Na2O2 淡黄色 2Na2O2+2H2O=4NaOH+O2↑ 用带火星的木条放在试管口,看是否复燃
Na2O2 淡黄色 2Na2O2+2H2O=4NaOH+O2↑ 用带火星的木条放在试管口,看是否复燃
【解析】
(1)由于Na性质较活泼,与空气中的O2和水蒸气反应且Na的密度比煤油大,故放在煤油中隔绝空气保存,答案选D;
(2)金属钠在空气中的变化过程如下:Na![]() Na2O
Na2O![]() NaOH(s)
NaOH(s)![]() NaOH溶液
NaOH溶液![]() Na2CO3溶液
Na2CO3溶液![]() Na2CO3·10H2O
Na2CO3·10H2O![]() Na2CO3,答案选D;
Na2CO3,答案选D;
(3)钠在加热或点燃条件下和氧气反应生成淡黄色的Na2O2固体,化学方程式为2Na+O2![]() Na2O2,Na2O2和水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,检验氧气可以用带火星的木条,看是否复燃,故答案为:2Na+O2
Na2O2,Na2O2和水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,检验氧气可以用带火星的木条,看是否复燃,故答案为:2Na+O2![]() Na2O2;淡黄色;2Na2O2+2H2O=4NaOH+O2↑;用带火星的木条放在试管口,看是否复燃。
Na2O2;淡黄色;2Na2O2+2H2O=4NaOH+O2↑;用带火星的木条放在试管口,看是否复燃。


科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的配制中。某工厂以重晶石(主要含BaSO4)为原料生产钛酸钡的工艺流程如图:

回答下列问题:
(1)利用焰色反应的原理可定性鉴别某些金属盐。灼烧钛酸钡样品时,钡的焰色为______(填标号)。
A.砖红色 B.黄绿色 C.紫色 D.黄色
(2)用Na2CO3溶液浸泡重晶石(杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=_________。(已知Kap(BaSO4)=1.2×10-10、Kap(BaCO3)=2.4×10-9)。
(3)流程中“混合”溶液中的钛元素在不同pH时主要以Ti(OH)+、TiOC2O4、TiO(C2O4)23-这三种形式存在(变化曲线如图所示)。实际制备工艺中,先用氨水调节混合溶液的pH在______,再进行“沉淀”,写出该条件下生成草酸氧钛钡晶体的离子方程式:__________。
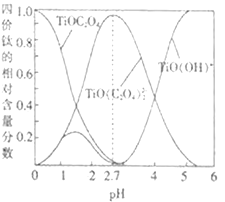
(4)检验草酸氧钛钡晶体是否洗涤干净的操作是_________。
(5)隔绝空气煅烧草酸氧钛钡晶体得到BaTiO3的同时,还能得到气体产物有H2O(g)、________;
(6)BaTiO3成品中C2O42-的含量可以用“氧化还原滴定法”测得。称取m g样品,置于烧杯中,加入50mL0.2 mol·L-1酸性高锰酸钾溶液充分反应后配制成100mL溶液,取20mL该溶液于锥形瓶中用0.1 mol·L-1的硫酸亚铁溶液进行滴定,滴定达到终点的标志是__________,重复滴定3次,平均每次消耗硫酸亚铁溶液的体积为20mL,则BaTiO3成品中C2O42-的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是___(填化学式);氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是___。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置,这时候,观察到的现象是___;
(3)若采用如图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①___;该装置还缺少的仪器是___;
(4)上面实验中用到一定物质的量浓度的稀硫酸,在配制稀硫酸溶液的过程中,下面操作造成所配稀硫酸溶液浓度偏高的是___。
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
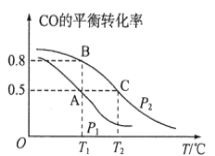
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图所示(写出最佳答案)
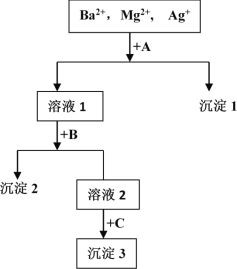
(1)沉淀的化学式:沉淀1______________,沉淀2______________,沉淀3______________;
(2)写出混合液 + A的离子方程式_____溶液1 + B的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,试回答:
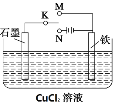
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”)铁极上的电极反应式为________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为________,铁极上的现象为________,石墨电极的反应现象为________,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;②2CuO+C
2CuO+CO2↑+H2O;②2CuO+C![]() 2Cu+CO2↑;③CuO+CO
2Cu+CO2↑;③CuO+CO![]() Cu+CO2;④CO2+C
Cu+CO2;④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①____________,②____________,④____________。
(2)从氧化还原反应的角度看,属于氧化还原反应的有____________。
(3)反应③中,____________发生氧化反应,__________发生还原反应。
(4)请在下图中用斜线表示反应③所属的区域。
 ;_______
;_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com