
【题目】实验室中,下列行为不符合安全要求的是
A.点燃甲烷前,先验纯
B.用手将灼热的蒸发皿拿离火焰,直接放在实验台上
C.实验结束后,将废液倒入指定容器中
D.稀释浓硫酸时,将浓硫酸沿烧杯壁缓缓倒入水中并不断搅拌
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A. 混合气体的密度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1mol H-H键的同时生成2mol H-I键
D. 容器内气体的浓度c(H2)∶c(I2)∶c(HI) = 1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )
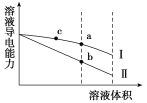
A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。10月25日,农业农村部新闻办公室发布,贵州省毕节市发生非洲猪瘟疫情。目前最有效的药物要主要成分的一种合成路线如图所示:

已知:
①E、G能发生银镜反应
②R—CHO+R′—CH2—CHO ![]()
 (R、R表示烃基或氢)。
(R、R表示烃基或氢)。
请回答下列问题:
(1)G的名称是____________________;D中所含官能团的名称是____________________。
(2)Y的结构简式为__________________;A生成B的反应类型是__________________。
(3)据最新报道,乙烯与双氧水在催化剂作用下反应生成B,产率较高。写出该反应的化学方程式____________________________________________。
(4)简述逐一检测出F中官能团的实验操作与现象结论______________________。
(5)在J的同分异构体中,同时满足下列条件的同分异构体有___________种。
i.既能发生水解反应,又能发生银镜反应;
ii.遇氯化铁溶液发生显色反应。
(6)参照上述流程,以苯乙烯为原料,设计路线制备某药物中间体
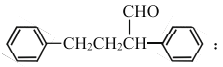 _________________________________。
_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程式是________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中HCO3―、CO32―、H2CO3 三种微粒的浓度由大到小的顺序为:_______________________________。
(2)NaHCO3溶液与硫酸铝溶液混合的离子方程式_______________________________。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是
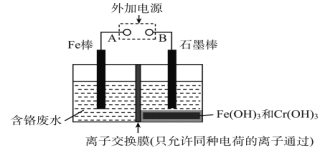
A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com