
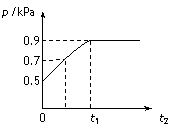
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) DH<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) DH<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
A. 从反应开始到t1时的平均反应速率v(X)=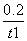 mol/(L·min)
mol/(L·min)
B. 该温度下此反应的平衡常数K=0.32
C. 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D. 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:__________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
|
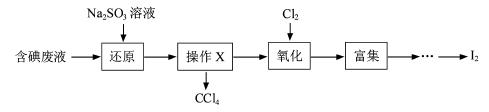
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ ;
②操作X的名称为___________________。
③已知:5SO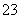 +2IO
+2IO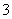 +2H+===I2+5SO
+2H+===I2+5SO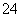 +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO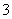 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO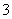 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO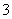 ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO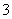 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质既能发生消去反应,又能发生水解反应的是
A.一氯甲烷 B.1—氯—2,2—二甲基丙烷
C.1—溴—2—甲基丙烷 D.3—氯—2,2,4,4—四甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用以下反应制取少量氮气: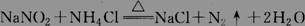 ,
,
关于该反应的下列说法正确的是 ( )
A. NaNO2是氧化剂 B.每生成1 mol N2转移的电子的物质的量为6 mol
C. NH4Cl的氮元素被还原 D. N2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是
A.油脂、糖类、蛋白质均是天然高分子化合物
B.三氯甲烷、氯乙烯、三溴苯酚均是卤代烃
C.CaCl2、烧碱、聚苯乙烯均为化合物
D.稀豆浆、硅酸、雾霾均为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式书写正确的
A.在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4
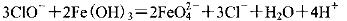
B.从酸化的海带灰浸出液中提取碘: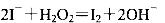
C.以金属银为阳极电解饱和硫酸铜溶液: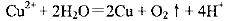
D.过氧化氢能使酸性KMnO4溶液褪色:
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(s) cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是

A.升高温度,平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.根据图像无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是 ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 ▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定。有关反应的化学方程式如下:
2Fe3++Sn2++6Cl—=2Fe2++SnCl62—
Sn2++4Cl—+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在 ▲ 滴定管中(填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量 ▲ (填“偏高”、“偏低”或“不变”)。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 ▲ (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ 。
b.沉淀: ▲ 。
c.分离,洗涤。
d.烘干,研磨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com