
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:__________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
|
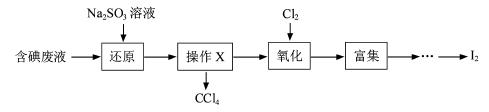
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ ;
②操作X的名称为___________________。
③已知:5SO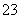 +2IO
+2IO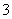 +2H+===I2+5SO
+2H+===I2+5SO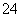 +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO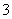 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO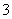 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO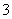 ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO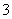 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
科目:高中化学 来源: 题型:
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
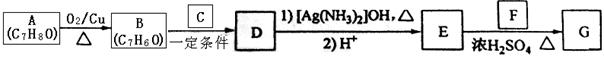
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
A.在此反应中硝酸只体现强氧化性
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | H2 | N H3 | NO |
| 气体N | SO2 | Cl2 | HCl | O2 |
A.①②③④ B.②④①③ C.④①②③ D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是


A.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2 Ba2+ + 4OH-= AlO2- + 2BaSO4↓+ 2H2O
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O
C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3?H2O
D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH- 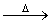 CH2BrCOO-+H2O
CH2BrCOO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
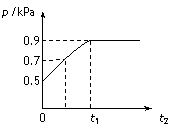
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) DH<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) DH<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
A. 从反应开始到t1时的平均反应速率v(X)=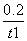 mol/(L·min)
mol/(L·min)
B. 该温度下此反应的平衡常数K=0.32
C. 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D. 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com