
【题目】将一定体积的CO2通入到一定浓度的NaOH溶液中,为了测定其溶液的成分,向该溶液中逐滴加入1mol/L盐酸。所加入盐酸的体积与产生二氧化碳气体体积(标准状况)的关系如图所示。
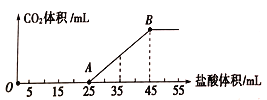
(1)写出OA段所发生反应的离子方程式: ______________________;
(2)当加入35mL盐酸时,所产生的二氧化碳的体积(标准状况)是______________________mL。
(3)溶液中所含的物质有_______________,其物质的量之比为_________________。
【答案】 H++OH-=H2O、CO32-+H+=HCO3- 224 NaOH、Na2CO3 1:4
【解析】(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,由于盐酸与碳酸钠反应生成碳酸氢钠消耗的盐酸体积与生成的碳酸氢钠再与盐酸反应消耗的盐酸体积相等,因此根据图像可知OA段0~5mL先发生酸碱中和,其离子反应方程式为H++OH-=H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+=HCO3-;(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,生成气体时消耗的酸的物质的量为0.01L×1molL-1=0.01mol,则根据方程式HCO3-+H+=CO2↑+H2O可知生成二氧化碳是0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL;(3)溶液中所含的物质有碳酸钠和氢氧化钠,由图可知氢氧化钠消耗盐酸的体积为5ml,而碳酸钠生成碳酸氢钠消耗盐酸为:20mL,碳酸钠和氢氧化钠与盐酸都是1:1反应,所以其物质的量之比等于消耗盐酸的体积之比,则物质的量之比为5:20=1:4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如下图所示:向饱和![]() 溶液中逐滴加入稀硫酸,不断搅拌至过量。
溶液中逐滴加入稀硫酸,不断搅拌至过量。
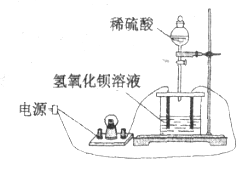
(1)主要的实验现象:烧杯中____________, 灯泡__________________。
(2)烧杯中反应的离子方程式:________________。
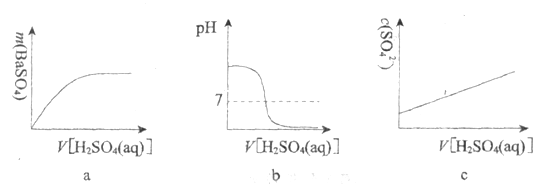
(3)下列图示能正确表示实验过程的是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮的固定的说法错误的是
A.氮的固定包括人工固氮和自然固氮
B.工业合成氨属于人工固氮
C.自然固氮中氮元素被氧化
D.氮的的固定中参与元素至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知光气COCl2的分解反应为COCl2(g)Cl2(g)+CO(g)△H=+108kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 
①计算反应在地8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6)v(15﹣16)(填“<”、“>”或“=”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3NO2+H2O═2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为
(2)氧化剂与还原剂的质量比为 .
(3)在标准状况下,336mL NO2与H2O完全反应转移的电子数目为 , 若所得硝酸溶液体积为60mL,则该溶液的物质的量浓度为
(4)请配平以下化学方程式:FeSO4+HNO3(稀)﹣Fe2(SO4)3+Fe(NO3)3+NO↑+H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com