
【题目】如下图所示:向饱和![]() 溶液中逐滴加入稀硫酸,不断搅拌至过量。
溶液中逐滴加入稀硫酸,不断搅拌至过量。
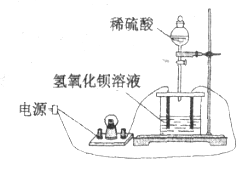
(1)主要的实验现象:烧杯中____________, 灯泡__________________。
(2)烧杯中反应的离子方程式:________________。
(3)下列图示能正确表示实验过程的是___________(填序号)。
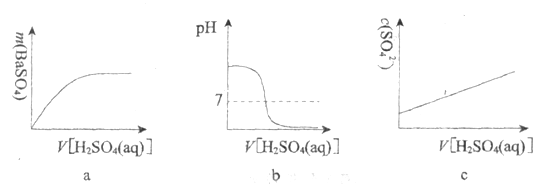
【答案】 产生白色沉淀 由亮变暗直至熄灭,后来又逐渐变亮 ![]() ab
ab
【解析】试题分析:本题以Ba(OH)2和H2SO4的反应为载体,考查实验现象的描述,离子方程式的书写,图像分析。开始为Ba(OH)2溶液,Ba(OH)2属于强碱,溶液中导电离子为Ba2+、OH-;加入H2SO4,发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,BaSO4难溶于水,H2O难电离,溶液中离子物质的量浓度减小,导电能力减弱;当两者恰好完全反应时,溶液中离子浓度接近0,导电能力接近0;继续加入H2SO4,H2SO4属于强酸,溶液中离子物质的量浓度增加,导电能力又增强。
(1)烧杯中的现象是产生白色沉淀;灯泡由亮变暗直至熄灭,后来又逐渐变亮。
(2)烧杯中的反应为Ba(OH)2+H2SO4=BaSO4↓+2H2O,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
(3)a项,随着硫酸的加入,BaSO4的质量逐渐增大,当Ba(OH)2与H2SO4恰好完全反应时BaSO4质量达最大,继续加入硫酸,BaSO4不再变化,正确;b项,随着硫酸的加入发生酸碱中和反应,溶液的pH减小,恰好完全反应时pH发生突变,硫酸过量后溶液呈酸性,正确;c项,开始溶液中SO42-为0,在Ba(OH)2没有完全反应之前,加入的SO42-与Ba2+形成难溶于水的BaSO4沉淀,溶液中c(SO42-)=0,Ba(OH)2完全反应后溶液中SO42-才逐渐增多,错误;答案选ab。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)已知H2的燃烧热:△H=﹣285.8kJmol﹣1 , C的燃烧热:△H=﹣393.5kJmol﹣1 , 若要得到1000kJ的热量,需完全燃烧mol的H2生成液态水;2.5molC在O2中完全燃烧生成CO2 , 放出kJ的热量,(保留到小数点后1位).
(2)0.05mol某液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24CO2(标准状况)并放出68.35kJ热量,则能表达该有机物燃烧热的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为( )
A.1:1
B.2:1
C.1:10
D.10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯I的合成路线如图: 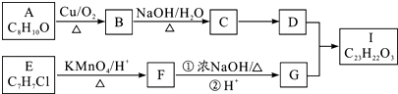
已知以下信息:
①A﹣I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种.
② ![]()
③ ![]()
请回答下列问题:
(1)A的结构简式 , C→D的反应类型为 , F中不含氧的官能团的名称为 , I的结构简式为 .
(2)E→F与F→G的顺序不能颠倒,理由
(3)B与银氨溶液反应的化学方程式为 , F→G①的化学方程式为 .
(4)G还可以通过缩聚反应制得高分子材料,试写出其结构简式 .
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有种,写出一种核磁共振氢谱有4组峰的分子的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素c可缓解亚硝酸盐中毒,说明维生素c具有
A. 氧化性B. 还原性C. 酸性D. 碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. KHSO4=K++HSO4- B. Ba(OH)2= Ba2++ OH2-
C. KOH=K++O2-+H+ D. KCl=K++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mol/L盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度为( )
A.0.05mol/L
B.0.25mol/L
C.0.1mol/L
D.0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定体积的CO2通入到一定浓度的NaOH溶液中,为了测定其溶液的成分,向该溶液中逐滴加入1mol/L盐酸。所加入盐酸的体积与产生二氧化碳气体体积(标准状况)的关系如图所示。
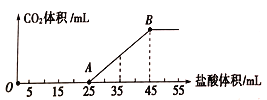
(1)写出OA段所发生反应的离子方程式: ______________________;
(2)当加入35mL盐酸时,所产生的二氧化碳的体积(标准状况)是______________________mL。
(3)溶液中所含的物质有_______________,其物质的量之比为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com