
【题目】强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为( )
A.1:1
B.2:1
C.1:10
D.10:1
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 . 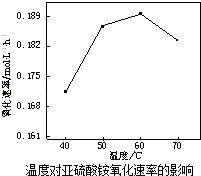
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= . [已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 .
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 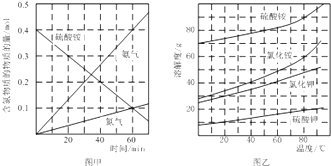
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是 ( )
A. 胶体粒子不能透过半透膜B. 胶体粒子大小在1nm - 100nm之间
C. 胶体粒子可以透过滤纸D. 光束穿过胶体时形成一条光亮的“通路”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl﹣没有画出),下列说法错误的是 ( )( ) 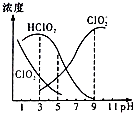
A.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
B.使用该漂白剂的最佳pH为3.0
C.25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
D.该温度下NaClO2溶液中:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体.氰化氢的沸点只有26℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险.同时氰化钠遇到亚硝酸钠会发生爆炸.回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 .
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理.氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 .
(3)爆炸残留在废水中的CN﹣可以用Cr2O72﹣处理,拟定下列流程进行废水处理 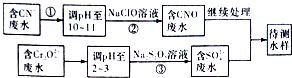
1)上述处理废水流程中主要使用的方法是;
a.混 凝法 b.中和法 c.沉淀法 d.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为;
3)步骤③中,每处理0.4 molCr2O72﹣时转移电子2.4 mol,该反应的离子方程式为;
4)处理酸性Cr2O72﹣废水多采用铁氧磁体法.该法是向废水中加入FeSO4 7H2O将Cr2O72﹣还原成Cr3+ , 调节pH,Fe、Cr转化成相当于FeⅡ[FexⅡCr(2﹣x)Ⅲ]O4 (铁氧磁体,右上角的罗马数字表示该元素的化合价)的沉淀.处理1 mol Cr2O72﹣ , 需加入amol FeSO4 7H2O,下列结论正确的是 .
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸.用电石炉废气(CO75%~90%,以及少量CO2、H2S、N2、CH4等),其合成部分工艺流程如下: 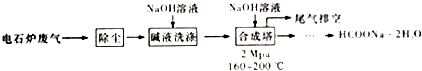
(1)上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).
(2)上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .
(3)合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.
(4)甲酸钠高温时分解制取草酸钠的化学方程式为 .
(5)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:向饱和![]() 溶液中逐滴加入稀硫酸,不断搅拌至过量。
溶液中逐滴加入稀硫酸,不断搅拌至过量。
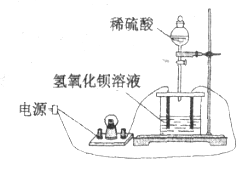
(1)主要的实验现象:烧杯中____________, 灯泡__________________。
(2)烧杯中反应的离子方程式:________________。
(3)下列图示能正确表示实验过程的是___________(填序号)。
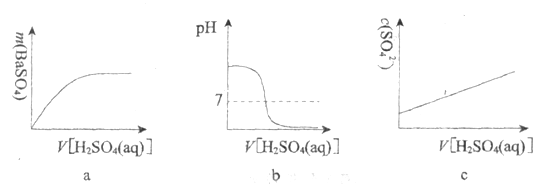
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com