
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 . 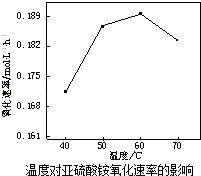
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= . [已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 .
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 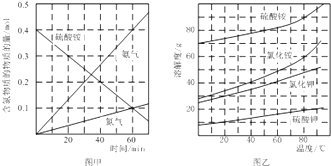
【答案】
(1)2a+2b+c
(2)温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低)
(3)3138
(4)2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;
4CuSO4+4NH3+2H2O;![]() ;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
【解析】解:(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1;盖斯定律计算目标反应的反应热为:①×2+②×2+③,2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=(2a+2b+c)KJ/mol,
故答案为:2a+2b+c;(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低),
故答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);(3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() =
= ![]() =3138,
=3138,
故答案为:3138;(4)①将黄铜精矿主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合电子守恒和原子守恒配平书写,反应的化学方程式为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O,
4CuSO4+4NH3+2H2O,
故答案为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;
4CuSO4+4NH3+2H2O;
②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写得到化学方程式为:3(NH4)2SO4 ![]() N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ ,
N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ ,
单线桥标出电子转移的方向及数目为: ![]() ,
,
故答案为: ![]() ;
;
③根据复分解反应发生的条件和图像中物质溶解度分析,常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行,工业上制备K2SO4晶体的设计思路是:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤得到,
故答案为:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤;
(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1;目标反应的反应热为:①×2+②×2+③,由此分析解答;(2)根据图1分析,60℃氧化速率最快,温度过高(NH4)2SO3会分解; (3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() ;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;
;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32-
C. 在强碱溶液中:Na+、K+、Cl-、SO32-
D. 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是
A.分子中共价键键角均为60°B.黄砷中共价键键能大于白磷
C.分子中含有的共价键的数目都是4D.黄砷的熔点低于白磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)已知H2的燃烧热:△H=﹣285.8kJmol﹣1 , C的燃烧热:△H=﹣393.5kJmol﹣1 , 若要得到1000kJ的热量,需完全燃烧mol的H2生成液态水;2.5molC在O2中完全燃烧生成CO2 , 放出kJ的热量,(保留到小数点后1位).
(2)0.05mol某液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24CO2(标准状况)并放出68.35kJ热量,则能表达该有机物燃烧热的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极). 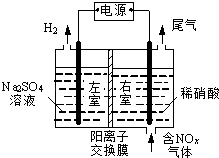
(1)若用NO2气体进行模拟电解法吸收实验. ①写出电解时NO2发生反应的电极反应式: .
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为mol.
(2)某小组在右室装有10L0.2molL﹣1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验. ①实验前,配制10L0.2molL﹣1硝酸溶液需量取mL的密度为1.4gmL﹣1、质量分数为63%的浓硝酸.
(3)②电解过程中,有部分NO转化为HNO2 , 实验结束时,测得右室溶液中含3molHNO3、0.1molHNO2 , 同时左室收集到标准状况下28LH2 . 计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列反应中电子转移发生在相同价态的同种元素之间的有________;电子转移发生在不同价态的同种元素之间的有________;电子转移发生在不同元素之间的有________。(填反应编号)
(1)Fe+2FeCl3![]() 3FeCl2
3FeCl2
(2)NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
(3)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(4)S+2KNO3+3C![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(5)Cl2+2NaOH![]() NaCl+NaClO+H2O
NaCl+NaClO+H2O
(6)HgS+O2![]() Hg+SO2
Hg+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯甲醛为原料制取苯甲醇和苯甲酸的合成反应如下: 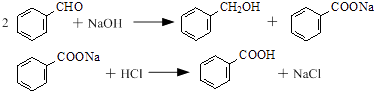
相关物质的部分物理性质见下表:
名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | ﹣26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | ﹣15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | ﹣116.3 | 34.6 | 不溶 | ﹣﹣ |
实验流程如下:
(1)萃取时苯甲醇在分液漏斗的(填“上”或“下”)层,分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是 .
(2)用NaHSO3溶液、10%Na2CO3溶液、H2O洗涤乙醚层. ①用10%Na2CO3溶液洗涤目的是 .
②操作Ⅰ名称是 .
(3)抽滤操作结束时先后进行的操作是 .
(4)提纯粗产品乙的实验方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为( )
A.1:1
B.2:1
C.1:10
D.10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com