
����Ŀ��2015��8��12�գ�������������ը�¹�ȷ�����軯�ơ��������Ƶȣ��軯�ƶ��Ժ�ǿ����ˮ���������ж���ȼ�軯�����壮�軯��ķе�ֻ��26�棬����൱���ӷ������������ʹ���������ж��ķ��գ�ͬʱ�軯�������������ƻᷢ����ը���ش���������
��1��д���軯����ˮ�����軯������ӷ���ʽ ��
��2����ը�ֳ�Լ700�ֵ��軯�ƴ�Լ��Ҫ900�ֵ�˫��ˮ���������軯����˫��ˮ�������ͷų�����ͬʱ������ɫ���壬ʹ���軯�ƵĶ��Դ�ͣ�д���軯����˫��ˮ��Ӧ�Ļ�ѧ����ʽ ��
��3����ը�����ڷ�ˮ�е�CN��������Cr2O72���������ⶨ�������̽��з�ˮ���� 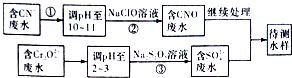
1������������ˮ��������Ҫʹ�õķ�������
a���� ���� b���кͷ� c�������� d��������ԭ��
2�����з�Ӧ��������ų����÷�Ӧ�����ӷ���ʽΪ��
3��������У�ÿ����0.4 molCr2O72��ʱת�Ƶ���2.4 mol���÷�Ӧ�����ӷ���ʽΪ��
4����������Cr2O72����ˮ������������巨���÷������ˮ�м���FeSO4 7H2O��Cr2O72����ԭ��Cr3+ �� ����pH��Fe��Crת�����൱��Fe��[Fex��Cr��2��x����]O4 ���������壬���Ͻǵ��������ֱ�ʾ��Ԫ�صĻ��ϼۣ��ij���������1 mol Cr2O72�� �� �����amol FeSO4 7H2O�����н�����ȷ���� ��
A��x=0.5��a=6 B��x=0.5��a=10 C��x=1.5��a=6 D��x=1.5��a=10��
���𰸡�
��1��CN��+H2O?HCN+OH��
��2��NaCN+H2O2+H2O�TNaHCO3+NH3��
��3��d��CN��+ClO���TCNO��+Cl����3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��D
���������⣺��1���軯������ˮ������軯�⣬����ʽΪCN��+H2OHCN+OH�� �� ���Դ��ǣ�CN��+H2OHCN+OH������2���軯����˫��ˮ��Ӧ���ɰ�����̼�����ƣ�����ʽΪNaCN+H2O2+H2O�TNaHCO3+NH3�������Դ��ǣ�NaCN+H2O2+H2O�TNaHCO3+NH3������3�����̷�����CN����ˮ������ҺPH����NaClO��Һ������CN�����ӷ�Ӧ����CNO���ķ�ˮ����Cr2O72���ķ�ˮ������ҺPH����Na2S2O3����������ԭ��Ӧ�õ�����������ӵķ�ˮ���ͺ�CNO���ķ�ˮ���������õ�����ˮ����1�������̿���CN��ת��ΪCNO�� �� ���ϼ����߱�������������Cr2O72��ת��ΪCr3+���ϼ۽��ͣ��ʻ�ԭ����ԭ���ʲ��÷���Ϊ��������ԭ�������Դ��ǣ�d��2��������У�������ų���CN����ClO������ΪCNO�� �� ����Ϊ���ڼ��Ի����У���ClO��ֻ�ܱ���ԭΪCl�� �� ��ӦʽΪ��CN��+ClO���TCNO��+Cl����
���Դ��ǣ�CN��+ClO���TCNO��+Cl����3��ÿ0.4molCr2O72��ת��2.4mol�ĵ��ӣ��軹ԭ��CrԪ�صĻ��ϼ�Ϊx����0.4mol��2����6��x��=2.4mol�����x=+3�������ӷ�ӦΪ3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��
���Դ��ǣ�3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��4������1mol Cr2O72�� �� �����a mol FeSO47H2O�����ݸ�ԭ���غ�ã�1mol Cr2O72����ȫ��Ӧ������ ![]() molFe��[Fe��xCr��2��x]O4 �� ������ԭ���غ��amol=
molFe��[Fe��xCr��2��x]O4 �� ������ԭ���غ��amol= ![]() mol�٣��÷�Ӧ�е�ʧ��������ȣ�1mol��2��3=
mol�٣��÷�Ӧ�е�ʧ��������ȣ�1mol��2��3= ![]() mol����3��2����x�����x=1.5����x=1.5����ٵ�a=10��
mol����3��2����x�����x=1.5����x=1.5����ٵ�a=10��
���Դ��ǣ�D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ�Ϊ500 mL���ܱ������У�����5 mol H2��2 mol CO����һ���¶Ⱥ�һ��ѹǿ�£��������·�Ӧ��
2H2(g)��CO(g)![]() CH3OH(g)������5 min��ﵽƽ��״̬������ʱ���CH3OH������Ũ��Ϊ2 mol��L��1����
CH3OH(g)������5 min��ﵽƽ��״̬������ʱ���CH3OH������Ũ��Ϊ2 mol��L��1����
(1)��H2��Ũ�ȱ仯��ʾ�ĸ÷�Ӧ�����ʡ�
(2)�ﵽƽ��ʱCO��ת���ʡ�
(3)���¶��µ�K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�ж��ַ���������и��ݲ������ת�Ƶ�Ԫ�����ͬ�ķ������������з�Ӧ�е���ת�Ʒ�������ͬ��̬��ͬ��Ԫ��֮�����________������ת�Ʒ����ڲ�ͬ��̬��ͬ��Ԫ��֮�����________������ת�Ʒ����ڲ�ͬԪ��֮�����________��(�Ӧ���)
(1)Fe+2FeCl3![]() 3FeCl2
3FeCl2
(2)NH4NO3![]() N2O��+2H2O
N2O��+2H2O
(3)2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
(4)S+2KNO3+3C![]() K2S+N2��+3CO2��
K2S+N2��+3CO2��
(5)Cl2+2NaOH![]() NaCl+NaClO+H2O
NaCl+NaClO+H2O
(6)HgS+O2![]() Hg+SO2
Hg+SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX��g��+Y��g��2Z��g������H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ���ǣ� ��
A.0��2 min��ƽ������v��Z��=2.0��10��3 molL��1min��1
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ v��������v���棩
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=144
D.�����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǿ����ҺA��ǿ����ҺB���ڳ�������pH֮��Ϊ15�������ǰ�һ������Ȼ��ʱ����Һ��pHǡ��Ϊ7����A��B�������Ϊ�� ��
A.1��1
B.2��1
C.1��10
D.10��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص���ʵ�˵������ȷ���ǣ� ��
A. ʯī�ܵ��磬����ʯī�ǵ����
B. ̼�����ˮ�е��ܽ�Ⱥ�С�����ܽ�IJ���ȫ�����룬����̼���Ϊ�����
C. ������̼��ˮ��Һ���ܵ��磬�������Ƕ��ǵ����
D. ˮ�ѵ��룬��ˮ���������磬����ˮ�Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I�ĺϳ�·����ͼ�� 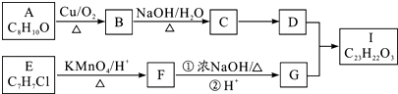
��֪������Ϣ��
��A��I��Ϊ�����廯���B�ܷ���������Ӧ��D����Է���������C��4��E�ı����ϵ�һ����������֣�
�� ![]()
�� ![]()
��ش��������⣺
��1��A�Ľṹ��ʽ �� C��D�ķ�Ӧ����Ϊ �� F�в������Ĺ����ŵ�����Ϊ �� I�Ľṹ��ʽΪ ��
��2��E��F��F��G��˳���ܵߵ�������
��3��B��������Һ��Ӧ�Ļ�ѧ����ʽΪ �� F��G�ٵĻ�ѧ����ʽΪ ��
��4��G������ͨ�����۷�Ӧ�Ƶø߷��Ӳ��ϣ���д����ṹ��ʽ ��
��5��A��ͬ���칹��ܶ࣬������ʹFeCl3��Һ����ɫ���֣�д��һ�ֺ˴Ź���������4���ķ��ӵĽṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�еĵ��뷽��ʽ��ȷ����
A. KHSO4=K++HSO4- B. Ba(OH)2= Ba2++ OH2-
C. KOH=K++O2-+H+ D. KCl=K++Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mL 0.1mol/L��H2SO4��ˮϡ�ͳ�2L��Һ���ڴ���Һ����ˮ���������H+ �� ��Ũ�Ƚӽ��ڣ� ��
A.1��10��4mol/L
B.1��10��8mol/L
C.1��10��11mol/L
D.1��10��10mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com