
【题目】把1mL 0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+ , 其浓度接近于( )
A.1×10﹣4mol/L
B.1×10﹣8mol/L
C.1×10﹣11mol/L
D.1×10﹣10mol/L
【答案】D
【解析】解:把1mL 0.1mol/L的H2SO4加水稀释成2L溶液,依据溶质物质的量不变得到,稀释后的溶液浓度为 ![]() =0.00005mol/L,溶液中氢离子浓度=0.0001mol/L;
=0.00005mol/L,溶液中氢离子浓度=0.0001mol/L;
依据溶液中离子积Kw=c(H+)(酸)×c(OH﹣)(水)=10﹣14;得到溶液中由水电离产生的c(H+)(水)=c(OH﹣)(水)=1×10﹣10mol/L,
故选D.
【考点精析】通过灵活运用离子积常数,掌握水的离子积Kw=c(H+)·c(OH–)=10–14(25℃)①Kw只与温度有关,温度升高,Kw增大;如:100℃ Kw=10–12②Kw适用于纯水或稀酸、稀碱、稀盐水溶液中即可以解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体.氰化氢的沸点只有26℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险.同时氰化钠遇到亚硝酸钠会发生爆炸.回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 .
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理.氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 .
(3)爆炸残留在废水中的CN﹣可以用Cr2O72﹣处理,拟定下列流程进行废水处理 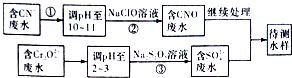
1)上述处理废水流程中主要使用的方法是;
a.混 凝法 b.中和法 c.沉淀法 d.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为;
3)步骤③中,每处理0.4 molCr2O72﹣时转移电子2.4 mol,该反应的离子方程式为;
4)处理酸性Cr2O72﹣废水多采用铁氧磁体法.该法是向废水中加入FeSO4 7H2O将Cr2O72﹣还原成Cr3+ , 调节pH,Fe、Cr转化成相当于FeⅡ[FexⅡCr(2﹣x)Ⅲ]O4 (铁氧磁体,右上角的罗马数字表示该元素的化合价)的沉淀.处理1 mol Cr2O72﹣ , 需加入amol FeSO4 7H2O,下列结论正确的是 .
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S、N、Cl都是重要的非金属元素,下列说法正确是( )
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.SO32﹣、ClO﹣、NO3﹣三种离子在溶液中因发生氧化还原反应而不能大量共存
C.浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性
D.标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知光气COCl2的分解反应为COCl2(g)Cl2(g)+CO(g)△H=+108kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 
①计算反应在地8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6)v(15﹣16)(填“<”、“>”或“=”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用过滤的方法可以除去食盐水中的泥沙
B. 酒精灯加热烧瓶时不用垫石棉网
C. 氯化氢气体能使干燥的蓝色石蕊试纸变红
D. 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com