
【题目】甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸.用电石炉废气(CO75%~90%,以及少量CO2、H2S、N2、CH4等),其合成部分工艺流程如下: 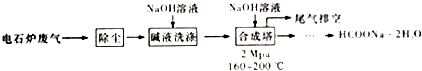
(1)上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).
(2)上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .
(3)合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.
(4)甲酸钠高温时分解制取草酸钠的化学方程式为 .
(5)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .
【答案】
(1)除去其中的CO2、H2S等酸性气体;CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O
(2)使尾气中的CO被充分吸收;N2、CH4
(3)蒸发浓缩;冷却结晶
(4)2HCOONa NaOOCCOONa+H2↑
(5)HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O
【解析】解:电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160﹣200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4 , 将尾气排空,(1)碱液具有碱性,能吸收酸性气体,CO2、H2S都是酸性气体,被碱液吸收,发生的反应为CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O,所以答案是:除去其中的CO2、H2S等酸性气体;CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O;(2)反应物接触面积越大,反应越充分,合成工艺中采用循环喷射吸收合成目的是增大反应物接触面积,使尾气中的CO被充分吸收;反应过程中N2、CH4不参加反应,所以最后排空的尾气主要成分是N2和CH4 ,
所以答案是:使尾气中的CO被充分吸收;N2、CH4;(3)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到,
所以答案是:蒸发浓缩;冷却结晶;过滤;(4)甲酸钠高温时分解生成草酸钠和氢气,反应方程式为2HCOONa
NaOOCCOONa+H2↑,
所以答案是:2HCOONa
NaOOCCOONa+H2↑;(5)反应物是甲酸钠、NaOH和二氧化硫,生成物是Na2S2O4和二氧化碳、水,离子反应方程式为HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O,
所以答案是:HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O.


科目:高中化学 来源: 题型:
【题目】砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是
A.分子中共价键键角均为60°B.黄砷中共价键键能大于白磷
C.分子中含有的共价键的数目都是4D.黄砷的熔点低于白磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯甲醛为原料制取苯甲醇和苯甲酸的合成反应如下: 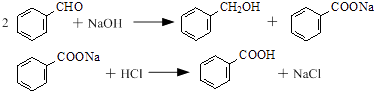
相关物质的部分物理性质见下表:
名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | ﹣26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | ﹣15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | ﹣116.3 | 34.6 | 不溶 | ﹣﹣ |
实验流程如下:
(1)萃取时苯甲醇在分液漏斗的(填“上”或“下”)层,分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是 .
(2)用NaHSO3溶液、10%Na2CO3溶液、H2O洗涤乙醚层. ①用10%Na2CO3溶液洗涤目的是 .
②操作Ⅰ名称是 .
(3)抽滤操作结束时先后进行的操作是 .
(4)提纯粗产品乙的实验方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为( )
A.1:1
B.2:1
C.1:10
D.10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 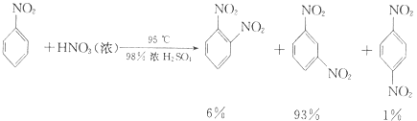
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
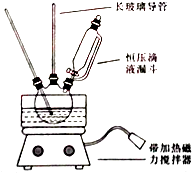
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯I的合成路线如图: 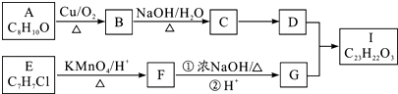
已知以下信息:
①A﹣I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种.
② ![]()
③ ![]()
请回答下列问题:
(1)A的结构简式 , C→D的反应类型为 , F中不含氧的官能团的名称为 , I的结构简式为 .
(2)E→F与F→G的顺序不能颠倒,理由
(3)B与银氨溶液反应的化学方程式为 , F→G①的化学方程式为 .
(4)G还可以通过缩聚反应制得高分子材料,试写出其结构简式 .
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有种,写出一种核磁共振氢谱有4组峰的分子的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素c可缓解亚硝酸盐中毒,说明维生素c具有
A. 氧化性B. 还原性C. 酸性D. 碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置。
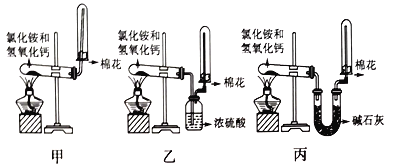
(1)写出实验室制氨气的化学反应方程式:_________________。
(2)实验室装置和所用样品都正确的是_________(填“甲”、“乙”、 “丙”)。
(3)检验试管里是否收集满了氨气的方法是:__________________。
(4)上述装置中,其中的一个装置肯定收集不到氨气的是_______,原因是(用化学方程式表示)___________________________。
(5)尾气处理时: 选择不可以用于处理氨气的________。
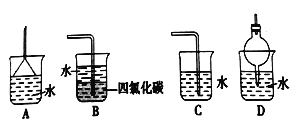
(6)氨的催化氧化是工业制硝酸的基础反应,写出反应的化学方程式__________。
II. 将红热的固体单质甲放入显黄色的溶液乙中剧烈反应产生混合气体A,A 在常温下不与空气作用,有如下变化关系:
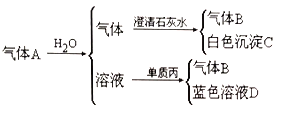
①推导出各物质的化学式B_______C________D________。
②写出甲跟乙反应的化学方程式:__________。A 溶于水发生的化学方程式__________。丙生成B 的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com