
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4mL 0.01mol/L KMnO4酸性 溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液 2mL,向另一只试管中加入0.1mol/L H2C2O4溶液 4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、②④③① | B、②③① |
| C、②⑤③① | D、②④③⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B、久置的氯水变成了稀盐酸 |
| C、在FeCl3溶液中加入铁粉防止氧化变质 |
| D、加入催化剂有利于SO2与O2反应制SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4、C2H6O |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O |
| D、CH4、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 系统命名为
系统命名为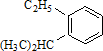 的炔烃的结构简式
的炔烃的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| Q | Q原子的质子数比T原子的核外电子数少3 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com