
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |

| 1 |
| 2 |
| 0.032g |
| 0.1L |
| Ksp |
| c(Cl-) |
| 2×10-10 |
| 1.0×10-5 |
| Ksp |
| c2(Ag+) |
| 1.12×10-12 |
| (2.0×10-5)2 |


科目:高中化学 来源: 题型:
| A、键角的大小与键长、键能的大小无关 |
| B、键长的大小与成键原子的半径和成键数目有关 |
| C、键角是描述分子立体结构的重要参数 |
| D、键能越大,键长越长,共价化合物越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加铁片的用量 |
| B、将2 mol?Lˉ1的硫酸改为98%的硫酸 |
| C、再加入10 mL 2 mol?Lˉ1的硫酸 |
| D、将铁片粉碎 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘131I原子核内所含中子数为78 |
| B、127I 和131I为两种核素A |
| C、碘127I原子和放射性碘原子131I属于同位素 |
| D、碘127I原子和碘131I原子的质子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4mL 0.01mol/L KMnO4酸性 溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液 2mL,向另一只试管中加入0.1mol/L H2C2O4溶液 4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 5 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
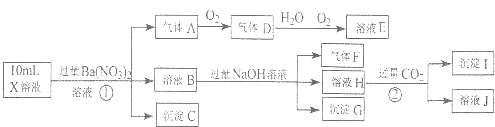
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B、具有相同电子数的两种微粒一定具有相同的化学性质 |
| C、两原子,如果核外电子排布相同,则一定属于同种元素 |
| D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com