
【题目】对于甲、乙、丙、丁、戊五种溶液有如下信息:
①分别NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)。
②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性。
③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
请回答下列问题:
⑴用化学式表示出各物质:乙___________、丁_____________。
⑵请用离子方程式表示戊溶液呈酸性的原因:________________________________。
⑶请用离子方程式表示甲与乙的反应:______________________________________。
⑷检验甲溶液中甲的阴离子的方法是先加_______________试剂,再加_________试剂,观察到
________________现象,证明该阴离子存在。
⑸若丙、丁形成的白色沉淀的溶度积常数Ksp=1.8×10-20,则将1 L 1mol/L的丙溶液与1 L 1 mol/L的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离子的浓度约为_______mol/L。
【答案】Na2CO3 BaCl2 NH4++H2O![]() NH3·H2O+H+ 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 足量的盐酸 BaCl2 白色沉淀 3.6×10-20mol·L-1
NH3·H2O+H+ 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 足量的盐酸 BaCl2 白色沉淀 3.6×10-20mol·L-1
【解析】
甲、乙反应生成白色沉淀和气体,且乙溶液呈碱性,甲溶液呈酸性,因此乙中含有CO32-,甲中含有Al3+,二者反应生成氢氧化铝和CO2,所以乙是碳酸钠。银离子只能与NO3-结合,即一定有物质硝酸银。丁可分别与甲、乙、丙反应生成白色沉淀,且丁的溶液是中性的,所以丁是氯化钡,则甲是硫酸铝,丙是硝酸银,因此戊是溴化铵。
(1)有上述分析可知,乙为Na2CO3,丁为BaCl2;
(2)NH4+水解显酸性,方程式为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)铝离子水解显酸性,CO32-水解显碱性,二者相互促进,方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(4)检验SO42-要排除其它阴离子的干扰,所以要要加入盐酸,再加入氯化钡溶液,如果产生白色沉淀,则证明SO42-离子存在。
(5)根据题意反应后,溶液中氯离子浓度是0.5mol/L,所以根据溶度积常数表达式可知,溶液中银离子的是![]() 3.6×10-20mol/L。
3.6×10-20mol/L。


科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
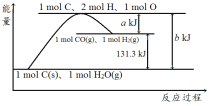
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN、CN-在溶液中存在下列平衡及其对应的平衡常数:①HCN![]() H++ CN- △H 1>0,K1 ②CN-+H2O
H++ CN- △H 1>0,K1 ②CN-+H2O ![]() HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
A. 混合溶液的pH<7
B. 对混合溶液进行微热,K1 增大、K2 减小
C. K2≈ 1.6×10-5
D. c(Na+) = c(HCN) + c(CN—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
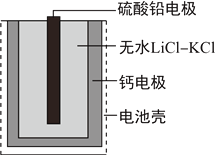
A. 放电时,电子由Ca电极流出
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2mol电子,理论上生成20.7 g Pb
D. 负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关,下列说法不正确的是![]()
![]()
A.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
B.向污水中投放明矾,利用生成的胶体净水:![]() 胶体
胶体![]()
C.煤的气化、液化、干馏和石油的裂化、裂解、催化重整都是化学变化
D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
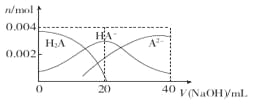
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com