
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
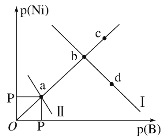
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线Ⅰ,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO32-
【答案】C
【解析】
A. 常温下Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7,Ksp(NiS)<Ksp(NiCO3),NiS和NiCO3 属于同种类型,则常温下NiCO3的溶解度大于NiS的溶解度,A项正确;
B.Ksp(NiS)<Ksp(NiCO3),则曲线Ⅰ代表NiS,曲线Ⅱ代表NiCO3,在d点溶液中存在溶解平衡![]() ,加入
,加入![]() ,
,![]() 浓度增大,平衡逆向移动,
浓度增大,平衡逆向移动,![]() 浓度减小,d点向b点移动,B项正确;
浓度减小,d点向b点移动,B项正确;
C. 对曲线Ⅰ在b点加热,NiS的溶解度增大,![]() 和
和![]() 浓度浓度增大,b点向a点方向移动,C项错误;
浓度浓度增大,b点向a点方向移动,C项错误;
D. 曲线Ⅱ代表NiCO3,a点![]() ,
,![]() =1.0×10-7,
=1.0×10-7, ![]() ,
,![]() ,且对应的阴离子为
,且对应的阴离子为![]() ,D项正确。
,D项正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】利用下列实验装置能达到实验目的的是
A.  分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液
B.  验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应
C.  蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体
D. 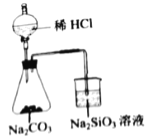 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知X在一定条件下转化为Y,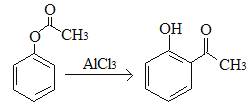 ,X与Y互为同分异构体,可用FeCl3溶液鉴别
,X与Y互为同分异构体,可用FeCl3溶液鉴别
B. 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
C.淀粉、蛋白质最终的水解产物都只有一种
D.香柠檬粉具有抗氧化功能,结构为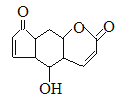 ,它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH
,它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。

请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有_____,一定不存在的离子有_____(写化学式)。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图为:
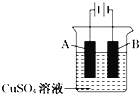
(1)A电极对应的金属是________(写元素名称),B电极的电极反应式是________;
(2)若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为________;
(3)镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:I. ![]()
![]() ;
;
II. ![]()
![]() ;
;
回答下列问题:
(1)已知几种化学键的键能如表所示:
化学键 |
|
|
|
|
键能/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() 。
。
(2)400K时,在密闭容器中将等物质的量的![]() 和
和![]() 混合,采用适当的催化剂进行反应,生成
混合,采用适当的催化剂进行反应,生成![]() ,达到平衡时测得
,达到平衡时测得![]() ,则平衡时
,则平衡时![]() _____
_____![]() 。
。
(3)据前人研究发现乙炔在![]() 团簇表面催化加氢反应的部分历程如图所示,其中吸附在
团簇表面催化加氢反应的部分历程如图所示,其中吸附在![]() 表面上的物种用*标注。
表面上的物种用*标注。

推测乙烯在![]() 表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______
表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______![]() ,该步骤的化学方程式为___________。
,该步骤的化学方程式为___________。
(4)![]() 时,将体积比为1:2的
时,将体积比为1:2的![]() 和
和![]() 充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为
充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为![]() ,实验测得
,实验测得![]() 的分压
的分压![]() 与反应时间
与反应时间![]() 的关系如图所示:
的关系如图所示:
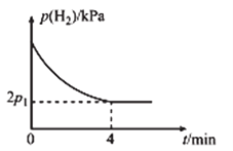
①![]() 时,
时,![]() 内,平均反应速率
内,平均反应速率![]() ______
______![]() (用含
(用含![]() 的代数式表示,下同)。
的代数式表示,下同)。
②![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() _____
_____![]() (
(![]() 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③![]() 时,
时,![]() 内,
内,![]() 的减小量______(填“>”“<”或“=”)
的减小量______(填“>”“<”或“=”) ![]() 内
内![]() 的减小量,理由为__________。
的减小量,理由为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com