
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
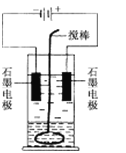
(1)阳极上的电极反应式为__________________________________________。
(2)阴极上的电极反应式为__________________________________________。
(3)原上层液体是____________________。
(4)原下层液体是______________
(5)搅拌后两层液体颜色发生变化的原因是___________________________
(6)要检验上层液体中含有的金属离子,其方法是___________________,现象是_______________________________________________________。
【答案】2I-—2e-=I2 2H++2e-= H2↑ NaI或KI 四氯化碳 I2易溶于四氯化碳,难溶于水 焰色反应 若焰色为亮黄色为NaI,通过蓝色钴玻璃观察,若焰色为紫色为KI
【解析】
(1)依据装置图可知阳极上是溶液中碘离子失电子生成碘单质;
(2)依据装置图分析可知阴极上的电极反应是溶液中氢离子得到电子生成氢气;
(3)原上层溶液中含有碘离子;
(4)下层是比水溶液重的不溶于水的试剂;
(5)碘在有几溶液中溶解度大于水中分析;
(6)上层是碘化钠或碘化钾溶液,依据金属离子的焰色反应设计实验检验。
(1)阳极周围的液体呈现棕色,且颜色由浅变深,萃取后呈紫红色,判断为碘单质生成,所以是溶液中碘离子失电子生成碘单质的反应,电极反应为2I2e═I2;故答案为:2I2e═I2;
(2)阴极上的电极反应是溶液中氢离子得到电子生成氢气,电极反应为:2H++2e═H2↑,故答案为:2H++2e═H2↑;
(3)原上层溶液中含有碘离子,可以是KI(或NaI等)水溶液,故答案为:KI(或NaI等)水溶液;
(4)下层是比水溶液重的不溶于水的试剂,分析过程可知是发生了萃取作用,可以是CCl4(或CHCl3等),故答案为:CCl4(或CHCl3等);
(5)搅拌后两层液体颜色发生变化,静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色,可知I2在CCl4中的溶解度大于在水中的溶解度,发生了萃取,
故答案为:I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中;
(6)上层是碘化钠或碘化钾溶液,依据金属离子的焰色反应设计实验检验,若是碘化钾溶液,则透过蓝色钴玻璃观察火焰呈紫色证明是钾元素,若③中答NaI水溶液,火焰呈黄色,
故答案为:焰色反应;若是碘化钾溶液,则透过蓝色钴玻璃观察火焰呈紫色证明是钾元素,若③中答NaI水溶液,火焰呈黄色。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)烃A的结构简式为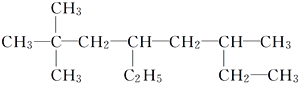 。用系统命名法命名烃A:__________________________________________________。
。用系统命名法命名烃A:__________________________________________________。
(2)某烃的分子式为C5H12,核磁共振氢谱图中显示三个峰,则该烃的一氯代物有________种,该烃的结构简式为________________。
(3)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构如下: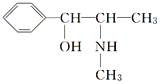 。下列各物质:
。下列各物质:
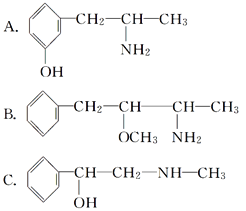
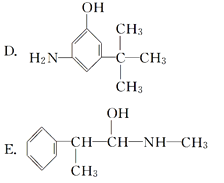
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
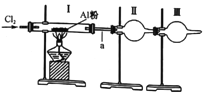
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是乙醇燃料电池的示意图,用能传递质子(H+)的介质作电解质溶液,反应为C2H5OH+3O2→2CO2+3H2O,下列说法正确的是( )
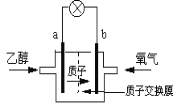
A.a极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e-=== 2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.电池工作时,1mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下,一定能大量共存的是( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
B.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO![]()
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
D.c(H+)=1×10-1 mol/L的溶液中:Cu2+、Al3+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
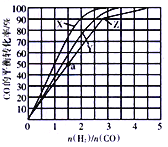
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol· (L·s)-1,同时生成1 mol D,下列叙述中错误的是( )
xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol· (L·s)-1,同时生成1 mol D,下列叙述中错误的是( )
A. 达到平衡状态时A的转化率为50%
B. x=4
C. 达到平衡状态时容器内气体的压强与起始时压强比为6∶5
D. 5 s内B的反应速率v(B)=0.05 mol · (L·s)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com