
【题目】现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
【答案】 ①② ③④ SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大 AC ![]()
【解析】(1)①SO2中S原子的价电子对数为![]() =3,所以杂化类型为sp2;②SO3中S原子的价电子对数为
=3,所以杂化类型为sp2;②SO3中S原子的价电子对数为![]() =3,所以杂化类型为sp2;③SO32-中S原子的价电子对数为
=3,所以杂化类型为sp2;③SO32-中S原子的价电子对数为![]() =4,所以杂化类型为sp3;④SO42-中S原子的价电子对数为
=4,所以杂化类型为sp3;④SO42-中S原子的价电子对数为![]() =4,所以杂化类型为sp3;故①②中心原子S的杂化方式为sp2;③④中心原子S的杂化方式为sp3;(2) SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大;(3)A、同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性,选项A正确;B. 硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+,而不是中心原子的孤电子对的原因,选项B错误;C、在H2SO4溶液中存在的粒子的空间构型有水为V形和硫酸根离子为正四面体形,选项C正确。答案选AC;(4) SO2中有3个原子,4个电子形成大п键,可表示为
=4,所以杂化类型为sp3;故①②中心原子S的杂化方式为sp2;③④中心原子S的杂化方式为sp3;(2) SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大;(3)A、同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性,选项A正确;B. 硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+,而不是中心原子的孤电子对的原因,选项B错误;C、在H2SO4溶液中存在的粒子的空间构型有水为V形和硫酸根离子为正四面体形,选项C正确。答案选AC;(4) SO2中有3个原子,4个电子形成大п键,可表示为![]() 。
。


科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是
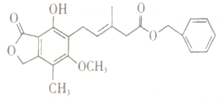
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
C. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D. 该化合物与足量NaOH反应可生成化学式为C16H17O7Na3的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:

步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,且与B同主族,C的基态原子2p能级上只有1个电子,F与A可形成两种常温下的液态化合物;F与G同主族。根据上述描述,请回答下列问题:
(1)上述7种元素中电负性最小的元素与A元素形成的化合物的电子式为______(用具体元素符号表示电子式),基态原子的一电离能最大的元素是_____(填元素符号)。
(2)1molD3A6链状分子中含有的σ键数为________。
(3)已知A2F2的分子结构如图所示:
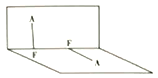
①用电离方程式表示呈弱酸性的原因:______________。
②A2F2的沸点比A2F高的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
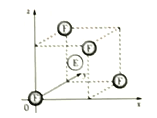
【题目】A为短周期元素,A-F6种元素在元素周期表中的位置如图所示,其中A的基态原子的能层序数与最外基电子数相等。回答下列问题(请用元素符号表示相关化学式):

(1)F的价电于排布式为_______________。
(2)B、C、D原子的电负性由大到小的顺序是_______________。
(3)化合物BE2微溶于水,为______(填“极性“成“非极性”)分子,BE2______ (填“能”或“不能”)分离常见的B的单质和正的单质的混合物。
(4)下图为FE晶胞的一部分,F原子的周围最近的E原子有__个;若FE晶胞参数为a,作为数轴单位,在坐标原点的F原于坐标参数记为(0,0,0),则图中E原子的坐标参数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 将1mol Cl2 通入足量水中,溶液中HC1O、Cl-、ClO- 粒子数之和为2NA
B. 100g CaCO3晶体和100g KHCO3晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO 和2.24L O2 混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O= HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O 参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.胶体在一定条件下能稳定存在
D.分散质粒子直径在1~100nm之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com