
【题目】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,且与B同主族,C的基态原子2p能级上只有1个电子,F与A可形成两种常温下的液态化合物;F与G同主族。根据上述描述,请回答下列问题:
(1)上述7种元素中电负性最小的元素与A元素形成的化合物的电子式为______(用具体元素符号表示电子式),基态原子的一电离能最大的元素是_____(填元素符号)。
(2)1molD3A6链状分子中含有的σ键数为________。
(3)已知A2F2的分子结构如图所示:
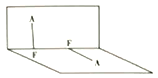
①用电离方程式表示呈弱酸性的原因:______________。
②A2F2的沸点比A2F高的原因:_______________。
【答案】 ![]() N 8NA(或4.816×1024或8×6.02×1023) H2O2
N 8NA(或4.816×1024或8×6.02×1023) H2O2![]() HO2-+H+ 因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高
HO2-+H+ 因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高
【解析】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,则为氢元素,且与B同主族,则B为锂元素,C的基态原子2p能级上只有1个电子,则C为硼元素,F与A可形成两种常温下的液态化合物水和双氧水,则F为氧元素;F与G同主族,则G为硫元素。D、E处于C、F之间,只能分别为碳元素和氮元素。(1)元素非金属性越弱电解性越弱,上述7种元素中电负性最小的元素为锂元素,与A元素形成的化合物氢化锂的电子式为![]() ,同周期元素从左到右第一电离能逐渐增大,N元素的2p轨道上为半满稳定结构,第一电离能反常增大,故基态原子的第一电离能最大的元素是N;(2) C3H6链状分子为丙烯分子,每个分子中含有8个σ键和1个
,同周期元素从左到右第一电离能逐渐增大,N元素的2p轨道上为半满稳定结构,第一电离能反常增大,故基态原子的第一电离能最大的元素是N;(2) C3H6链状分子为丙烯分子,每个分子中含有8个σ键和1个![]() 键,1molC3H6链状分子中含有的σ键数为8NA;(3) ①H2O2不完全电离产生氢离子使溶液呈弱酸性H2O2
键,1molC3H6链状分子中含有的σ键数为8NA;(3) ①H2O2不完全电离产生氢离子使溶液呈弱酸性H2O2![]() HO2-+H+;②因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高。
HO2-+H+;②因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高。


科目:高中化学 来源: 题型:
【题目】用CO 合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d) D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
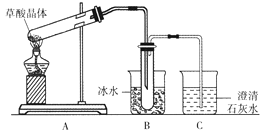
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为![]() ,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物C为中学常见的化合物。
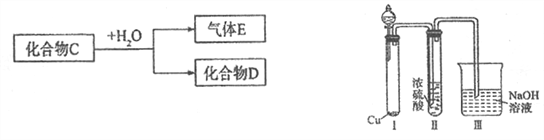
(1)若D是一种强酸,则C与水反应的化学方程式为__________________________。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________。
(2)若D是一种常见的强碱,则C的电子式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素V、W、X、Y、Z的原子序数依次增大。由这五种元素组成的九种物质中,n、r、u是气体单质,其余均为化合物;n是黄绿色气体,m是能使湿润的红色石蕊试纸变蓝的无色气体,p是无色液体,q是淡黄色固体。它们的转化关系如图所示。
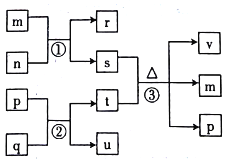
下列说法正确的是
A. 实验室制取m和u时,气体发生装置可以相同
B. 原子半径:W>X>Y
C. 反应①、②均为置换反应
D. n与t溶液反应时,t作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,AgCl与AgI的饱和溶液中存在如下关系,下列说法正确的是( )
A. 向2mL0.01 mol/L AgNO3溶液中加2滴0.01 mol/LNaCl溶液,静置片刻,再向溶液中加几滴0.01 mol/L KI溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
B. 向0.1 mol/L KI溶液中加入AgNO3溶液,当I-刚好完全沉淀时,c(Ag+)=2×10-12mol/L
C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,可使溶液由A点变到B点
D. AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq),在该温度下的平衡常数K=2.5×106
AgI(s)+Cl-(aq),在该温度下的平衡常数K=2.5×106
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com