
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 将1mol Cl2 通入足量水中,溶液中HC1O、Cl-、ClO- 粒子数之和为2NA
B. 100g CaCO3晶体和100g KHCO3晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO 和2.24L O2 混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O= HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O 参加反应,则被水还原的BrF3分子数目为2NA
【答案】C
【解析】
A.氯气溶于水,部分与水反应,部分以氯气分子形式存在,依据氯原子个数守恒,将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;B.100gCaCO3晶体的物质的量为1mol,含有1mol钙离子和1mol碳酸根离子,100gKHCO3晶体的物质的量为1mol,含有1mol钾离子和1mol碳酸氢根离子;离子数均为2NA,故B错误;C.标准状况下,4.48LNO 和2.24LO2 混合后,恰好反应生成4.48LNO2,物质的量为0.2mol,根据质量守恒定律,原子总数为0.6NA,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2↑中,元素化合价变化情况为:部分溴元素由+3价升高为+5价,部分溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂作用也起还原剂作用,同时水也起还原剂作用,若5molH2O参加反应,则生成1molO2,氧原子提供电子的物质的量为2mol×2=4mol,设被水还原的BrF3的物质的量为xmol,根据得失电子守恒有:4mol=xmol×(3-0),解得x=![]() mol,则被水还原的BrF3分子数目为
mol,则被水还原的BrF3分子数目为![]() NA,故D错误;答案选C。
NA,故D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的名称或化学式:
A(名称):_________E(名称):_________J(化学式):_________G(化学式):_________;
(2)按要求写方程式:
D转化为E的离子方程式:________________________________________________;
F在空气中转化为G的化学方程式:________________________________________;
电解C可以得到单质B,试写出B生成I的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶格能的叙述正确的是
A. 晶格能是原子形成1摩尔离子晶体释放的能量
B. 晶格能通常取正值,有时也取负值
C. 晶格能越大,形成的离子晶体越稳定
D. 晶格能越大,物质的硬度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素V、W、X、Y、Z的原子序数依次增大。由这五种元素组成的九种物质中,n、r、u是气体单质,其余均为化合物;n是黄绿色气体,m是能使湿润的红色石蕊试纸变蓝的无色气体,p是无色液体,q是淡黄色固体。它们的转化关系如图所示。
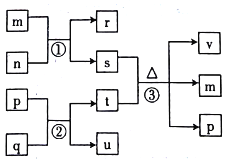
下列说法正确的是
A. 实验室制取m和u时,气体发生装置可以相同
B. 原子半径:W>X>Y
C. 反应①、②均为置换反应
D. n与t溶液反应时,t作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )

A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) D. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
对羟基苯甲酸丁脂(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得,以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯酸丁酯的合成路线:

已知以下信息:
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;D可与银氨溶液反应生成银镜; F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。回答下列问题:
(1)A的化学名称为__________;
(2)由B生成C的化学反应万程式为_____________________,该反应的类型为__________;
(3)D的结构简式为__________;
(4)F的分子式为__________;
(5)G的结构简式为__________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有__________种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是_____________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com