
【题目】对于反应中的能量变化,表述正确的是
A. 加热才能发生的反应肯定属于吸热反应
B. 化学变化时形成化学键的过程需吸收能量
C. 放热反应中,反应物的总能量大于生成物的总能量
D. 任何化学反应中的能量变化都表现为热量变化
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
① 醋酸在水溶液中的电离方程式为________________________________________________;
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号) 。
A.滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是______________(填“I”或“Ⅱ”);
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③ V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: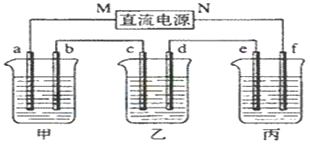
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2![]() H+ + O2-
H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为_____________。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
(6)如图所示, 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内的试剂或分离方法,除去下列各物质中少量的杂质或分离出物质,正确的是
A. 苯中的溴(碘化钾溶液) B. 汽油中的苯(水)
C. 煤焦油中的苯、甲苯、二甲苯(分液) D. 甲烷中的乙烯(溴水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯与液溴反应生成溴苯属于加成反应
B.葡萄糖能发生氧化反应和水解反应
C.分子式为C4H9Cl的同分异构体数目有4种(不考虑立体异构)
D.分子组成上相差1个或多个CH2原子团的物质互称为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,Cu与浓硫酸会发生氧化还原反应,某学校化学学习小组成员在实验室中对该实验进行了探究。回答下列问题:
(1)写出Cu与浓硫酸反应生成SO2的化学方程式:______________________________________。
(2)气体发生装置选取_______(选填“甲、乙、丙”)。



(3)成员甲采用下列装置探究混合气体中是否含有H2:

装置 | 装置中的试剂 | 装置作用 | 实验现象 |
A | NaOH浓溶液 | ① | |
B | 品红溶液 | ② | |
C | ③ | 干燥作用 | |
D | CuO | ④ | |
E | ⑤ | ||
F | 碱石灰 | ⑥ |
①___________________;②_________________;③______________________;④____________;⑤________________;⑥_________________________。
(4)某次实验结束后,Cu与浓硫酸反应后,Cu剩余,且铜片上附着黑色粉末物质。该小组成员乙查阅资料如下:
CuS为黑色粉末,难溶于水,在空气中加热至220℃以上时可迅速被氧气氧化生成黑色的CuO和SO2。
①该同学刮下铜片上的黑色物质,加入到试管中,然后加蒸馏水,振荡,静置后发现溶液为浅蓝色,由此确定该黑色粉末中含有___________。
②请你帮助该同学设计实验验证该黑色物质为CuS____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知标准状况下1.505×1023个X气体分子的质量为8g,则X气体的体积为________________,摩尔质量为__________。
(2)用20g烧碱配制成500mL溶液,其物质的量浓度为___________________mol/L;从中取出1mL,其物质的量浓度为______________________mol/L,含溶质________________g;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为_____________mol/L,其中含Na+__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com