
����Ŀ����Ҫ��ش��������⣺ I���������ʵ�����A��B��Ϸ���2L���ܱ������У�������Ӧ3A��g��+B��g��xC��g��+2D��g������5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c��A����c��B��=3��5��v��C��=0.1mol/��Lmin������
��1��x= ��
��2��ǰ5min��B�ķ�Ӧ����v��B��= ��
��3��ƽ��ʱA��ת����Ϊ ��
��4��II��ˮ����ͨ�����ȵ�̼�㷢����Ӧ��C��s��+H2O��g��CO��g��+H2��g����H�� ��֪��K��300�棩��K��350�棩����÷�Ӧ���ȷ�Ӧ��
��5��������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ���ʣ���������ʱ��ı仯����ͼ��ʾ�������Ӧ�ı�ţ� 
����С��������� �ڽ����¶�
��6����֪��Ӧ��CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g�� ����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2 �� ���¶��·�ӦCO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��K=����K1��K2��ʾ����
���𰸡�
��1��2
��2��0.05mol/��L?min��
��3��50%
��4����
��5��b�� f
��6��![]()
���������⣺I��D��Ũ��Ϊ0.5mol/L������D�����ʵ���Ϊ1mol��C���ʵ���=0.1mol/��Lmin����2L��5min=1mol��
��A��B�����ʵ���Ϊnmol��
3A��g��+ | B��g��= | xC��g��+ | 2D��g�� | |
��ʼ | n mol | n mol | 0 | 0 |
ת�� | 1.5mo | 0.5mol | 1mol | 1mol |
5min | ��n��1.5��mol | �� n��0.5��mol | 1mol | 1mol |
ͬһ�����У�c��A����c��B��=n��A����n��B��= ![]() =
= ![]() ��n=3mol����1��C�ķ�Ӧ������0.1mol/��Lmin����C���ʵ���=0.1mol/��Lmin����2L��5min=1mol��
��n=3mol����1��C�ķ�Ӧ������0.1mol/��Lmin����C���ʵ���=0.1mol/��Lmin����2L��5min=1mol�� ![]() =1������x=2��
=1������x=2��
�ʴ�Ϊ��2����2��C�ķ�Ӧ������0.1mol/��Lmin��������ͬһ��Ӧ�У������ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����B�ķ�Ӧ������ ![]() ��0.1mol/��Lmin��=0.05mol/��Lmin����
��0.1mol/��Lmin��=0.05mol/��Lmin����
�ʴ�Ϊ��0.05mol/��Lmin������3��A��ת����Ϊ�� ![]() ��100%=50%���ʴ�Ϊ��50%��
��100%=50%���ʴ�Ϊ��50%��
��4����֪��K��300�棩��K��350�棩�����¶�����ƽ�ⳣ������˵��ƽ��������У�����ӦΪ���ȷ�Ӧ���ʴ�Ϊ������ ��5������С���������ѹǿ����˲�����淴Ӧ���ʶ�����ƽ�����淴Ӧ�����ƶ����淴Ӧ����������࣬�������Ӧ����������ƽ�⣬������b���ϣ�
�ʴ�Ϊ��b��
�ڽ����¶ȣ�˲�����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�������Ӧ���ʼ�С���࣬�������Ӧ����������ƽ�⣬������ƽ��ʱ������С��ԭƽ������ʣ�����f���ϣ��ʴ�Ϊ��f����6����CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g����
��Ӧ�ٵ�ƽ�ⳣ��K1= ![]() ����Ӧ�ڵ�ƽ�ⳣ��K2=
����Ӧ�ڵ�ƽ�ⳣ��K2= ![]() ����Ӧ�ۣ�CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��ΪK=
����Ӧ�ۣ�CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��ΪK= ![]() =
= ![]() ��
��
�ʴ�Ϊ�� ![]() ��
��
������A��B�����ʵ���Ϊnmol������D��Ũ�ȼ���D�����ʵ���������D�����ʵ������㷴Ӧ��A��B�����ʵ���������5minʱ��A��BŨ��֮�����A��B��ʼʱ�����ʵ������ÿ�ʼʱ�����ʵ�������Ӧ�����ʵ�����Ϊ5minĩ�����ʵ������ٸ������ʵ���Ũ�ȹ�ʽ����Ũ�ȣ���Ӧ����֮�ȼ�Ϊ������֮�ȣ�����C�ķ�Ӧ������A�ķ�Ӧ���ʣ�����A��ת��Ũ�ȼ���A��ת���ʣ�
��4���¶�Խ��ƽ�ⳣ��Խ��˵������ƽ��������У���5������С���������ѹǿ����˲�����淴Ӧ���ʶ�����ƽ�����淴Ӧ�����ƶ����淴Ӧ����������࣬�������Ӧ����������ƽ�⣻
�ڽ����¶ȣ�˲�����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�������Ӧ���ʼ�С���࣬�������Ӧ����������ƽ�⣬������ƽ��ʱ������С��ԭƽ������ʣ���6���ɷ���ʽ��֪����Ӧ��=��Ӧ�٩���Ӧ�ڣ����ݻ�ѧƽ�ⳣ������ʽ�������Ƶ��жϣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C��һ��ˮ����ά���أ���ˮ��Һ�����ԣ������Ļ�ѧʽ��C6H8O6����Է�������176��������ȱ��������ά�����ܵû�Ѫ֢������ά����C�ֳƿ���Ѫ�ᣮ�����ʵ�ˮ�����߲ˡ�����Ʒ�ж�����ά����C�����紿��Ȼ��֭��ά����C�ĺ�����500mg/L���ң�ijУ����С��ⶨ��ij���ӵ�����װ��֭��ά����C�ĺ����������Dzⶨʵ��������森������д�йؿհף� �ŲⶨĿ�ģ��ⶨ����������װ��֭��ά����C�ĺ�����
�Ʋⶨԭ����C6H8O6+I2��C6H6O6+2H++2I��
��1��ʵ����Ʒ���Լ� ����������Ʒ���ԣ�
���Լ���ָʾ���������ƣ���Ũ��Ϊ7.50��10��3molL��1��I2����Һ������ˮ�ȣ�
��2��ʵ����� ��ϴ�����������ζ����Ƿ�©Һ����ϴ��װ�ñ�����Һ���ã�
���������������ƣ�����ƿ������20.00mL�����֭������2��ָʾ����
�������ֿ��Ƶζ��ܵ����λ��������ҡ����ƿ���۾�ע����ƿ����
Һ��ɫ�仯��ֱ���ζ��յ㣮�ζ����յ�ʱ�������� ��
��3�����ݼ�¼�봦�� �������ݴ������ζ������ı�����Һ�������15.00mL����˳�֭��ά����C�ĺ�����mol/L���ӷ������ݿ���������װ��֭�Ƿ��Ǵ���Ȼ��֭������ǡ����ǡ������ǡ���
��4���������ۣ����в����ᵼ������ά����C�ĺ���ƫ�ߵ���������ĸ��ţ���
A.��������������������
B.����ƿ�ô����֭��ϴ��
C.��ȡ��Һ�ĵζ���ˮϴ��δ�ô�װҺ��ϴ
D.����ƿ�к�������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦCO(g)��H2O(g)![]() CO2(g)��H2(g)���ﵽ�Ⱥ������һ����̼��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ(����)
CO2(g)��H2(g)���ﵽ�Ⱥ������һ����̼��ת���ʣ����Բ�ȡ�Ĵ�ʩΪ(����)
A. ʹ�ô��� B. ����ѹǿ
C. ����һ����̼��Ũ�� D. ����ˮ������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijɷ���ҪΪFeCr2O4������������Al2O3��SiO2���Ӹ���������ȡ�������Ļ�����,����ø�����Ĺ�������������
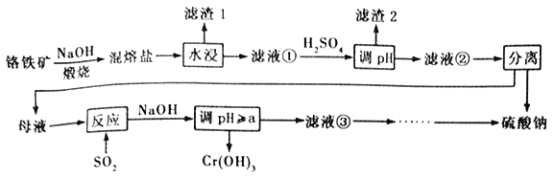
��֪�������Ρ��к���Na2CrO4��NaFeO2������NaFeO2����ˮ�⡣�Իش�����������
��1��������1��Ϊ���ɫ�������仯ѧʽΪ_________________������Һ���м�H2SO4����pH����Ŀ����һ��ʹCrO42-ת��ΪCr2O72- ������____________________________��
��2�������ա�������ʱ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��������ͼ�ܽ��(S)~�¶�(T)�����ж�������Һ�����е���ѡ����롱����Ϊ_________(�����)��
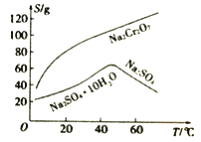
A.�����ᾧ B.����Ũ�������ȹ��� C.����Ũ������ȴ�ᾧ������
��4������Ӧ�������ӷ���ʽΪ_______________________________��
��5��Cr(OH)3������������������[CrCln(H2O) 6-n]x+��0.0015 mol [CrCln(H2O) 6-n]x+�������ӽ�����֬(HR)��ȫ�������ӽ�����
[CrCln(H2O) 6-n]x++xHR��Rx[CrCln(H2O) 6-n]+xH+�����ɵ�H+����25.00 mL0.1200 mol��L -1NaOH��Һǡ���к͡���������ӵĻ�ѧʽΪ__________________��
��6����֪25��ʱ��Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]=1.0��10-32����ʹCr3+ǡ����ȫ����������Һ��c(Cr3+) =1.0��10-5 mol��L -1ʱ��Ӧ������ҺpH����СֵaΪ����? (��ʽ����)____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС������ͼ1װ�ã��г�װ���ԣ��ռ�ij���Ѿ���SO2 �� ���Ժ������вⶨ�� 
��1������A�������� ��
��2��B�м���300.00mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ ��
��3����ȥC�й�����H2O2 �� Ȼ����0.0900mol/LNaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е� ��
��4�����ζ��յ�ʱ��Һ��pH=8.8����ѡ���ָʾ��Ϊ ��
��5���òⶨ���������ʵ��ֵƫ�ߣ����������ڲ����Լ���������ģ����ܵ�ԭ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgSO4��Al2��SO4��3�Ļ����Һ�У���μ���NaOH��Һ������ͼ���У�����ȷ��ʾ������Ӧ���ǣ��������ʾ����NaOH��Һ��������������ʾ��Ӧ���ɳ�������������������
A.
B.
C.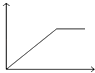
D.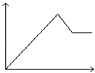
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ�����ֳ���������ʵĵ���ƽ�ⳣ�����±���ʾ:
����� | H3PO4 | NH3��H2O | C6H5OH |
����ƽ�ⳣ�� | K1=7.5��10-3 K2=7.5��10-8 K3=7.5��10-13 | 1.7��10-5 | 1.1��10-10 |
����˵����ȷ����
A. NaH2PO4��Һ�ʼ���
B. 25��ʱ��0.1moL/L��ˮ��pH=11+lg1.7
C. ����C6H5OH��Na3PO4��Ӧ�����ӷ���ʽΪ:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25��ʱ�����������Ũ�ȵı�����Һ�백ˮ��ϣ������Һ�и�����Ũ�ȹ�ϵ��c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���֤��ij��������һ���������Ӽ�����
A.������ˮB.����״̬�ܵ���
C.ˮ��Һ�ܵ���D.���нϸߵ��۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ������ͼ���õ����ʹ����ʯīI�缫������������Y������˵���������

A. Y�Ļ�ѧʽ����ΪNO
B. ʯīI��Ϊ������ʯī��Ϊ����
C. �õ�طŵ�ʱNO3-���Ҳ������Ǩ��
D. ʯīI���������ķ�ӦΪNO2+NO3����e��=N2O5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com