


(
| ||||
|
(
| ||||
|
| x-a |
| x+y-2a |
| x-b |
| x+y-2b |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
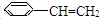 )5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空
)5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
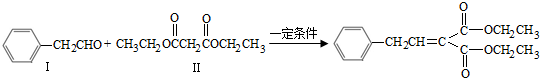
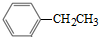 可合成化合物I.化合物Ⅳ是
可合成化合物I.化合物Ⅳ是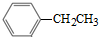 的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为
的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为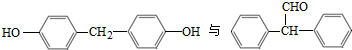 也可以发生类似反应①的反应,产物的结构式为
也可以发生类似反应①的反应,产物的结构式为查看答案和解析>>
科目:高中化学 来源: 题型:
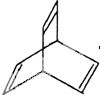 I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写
I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写 为.有机物X的键线式如图:
为.有机物X的键线式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com