
【题目】下列反应能发生并用于化工生产的是()
A.制盐酸:Cl2+H2![]() 2HCl
2HCl
B.制取镁:MgCl2(溶液)![]() Mg+Cl2
Mg+Cl2
C.制乙烯:C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.制乙醇:CH2=CH2+H2O![]() C2H5OH
C2H5OH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L15NH3中含有的质子数为11NA
B.含63gHNO3的浓硝酸与足量铜完全反应,转移电子数大于0.5NA
C.常温下,1L![]() 溶液中含有的氮原子数小于0.2NA
溶液中含有的氮原子数小于0.2NA
D.标准状况下,224mLSO2溶于水后形成的溶液中![]() 、
、![]() 、
、![]() 粒子数之和等于0.01NA
粒子数之和等于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是
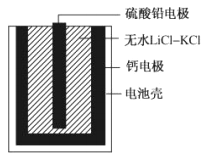
A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
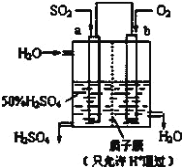
①上述生产硫酸的总反应方程式为_____,b 是_____极,b 电极反应式为______________,生产过程中H+向_____(填 a 或 b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置一定需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
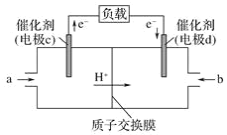
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)质子交换膜左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为___________________________。当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
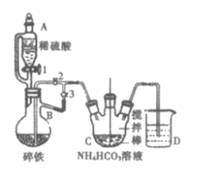
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M 在周期表中的位置关系如右图,对这些元素形成的单质或化合物推测正确的是( )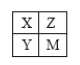
A.若Z元素形成的单质是Z2,则M元素形成的单质也一定是M2
B.若HnX常温下是气体,则HmZ 常温下也是气体
C.若有碱M(OH)n,则也一定有碱Y(OH)m
D.若Y有最高价含氧酸HnYOm,则X也一定有最高价含氧酸HnXOm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性:Cl2>IO3->Fe3+>I2,则对实验结果分析或预测正确的是( )
A.加碘食盐溶液中滴入少量白醋和淀粉 KI 溶液,溶液变蓝色,说明可能是 IO![]()
B.加碘食盐溶液中加入过量氯水后加淀粉,溶液不变蓝色,说明不可能是 I-
C.FeI2 溶液中滴加少量氯水,溶液中一定有 Fe3+生成
D.FeCl2 溶液中滴加足量碘水和 KSCN 溶液,溶液一定变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
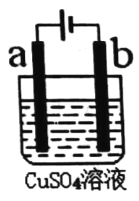
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2.3克某有机物在氧气中完全燃烧,只生成4.4克二氧化碳和2.7克水。
(1)计算确定该有机物的最简式________。
(2)若该有机物的相对分子质量为46,写出其分子式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com