
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}(��Է���������288)����������FeCO3��Ӧ�Ƶã���������ˮ�������������Ҵ��������ֽ⣬��һ�ֺܺõIJ�������
��.�Ʊ�̼��������װ����ͼ��ʾ��
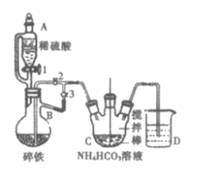
(1)����B��������___��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ����___��Ȼ�����2���رջ���___��
��.�Ʊ���������������FeCO3�����м�������������Һ����75���½���ʹ֮��ַ�Ӧ��
(3)�÷�Ӧ��ѧ����ʽΪ___��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ����___����Ӧ������������Һ�л��������������IJ������£��뽫ǰ�IJ���ȷ����(д��ĸ���)��___�����
a.���� b.�������������� c.��ȴ�ᾧ d.�������Ҵ�ϴ��
��.�����������崿�ȵIJ�����
(4)��K2Cr2O7�ζ����ⶨ������Fe2+�ĺ���������Ʒ���ȣ���ȡ6.00g��Ʒ���Ƴ�250.00mL��Һ��ȡ25.00mL��0.0100mol��L-1��K2Cr2O7����Һ�ζ����յ㣬���ı�Һ20.00mL�����Ʒ��������������Ĵ���Ϊ___(������������ʾ)��
���𰸡�������ƿ �ž�װ���ڵĿ�������ֹ���������������� 1��3 2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2��+H2O �������� bcad 57.6%
��������
��������������;��д��������������ϡ���ᷴӦһ��ʱ�䣬�����������ų��������ų������������������뵽����װ������̼�����������Ӧ����̼�������������̼��������Ӧ�������������Ͷ�����̼���������۷�ֹ�����������ʣ���Ӧ������Ҫ���������������������������������������Ҵ�������������Ҵ�ϴ�ӣ����ݹ�ϵʽ�����������������ʵ������ټ��㴿�ȡ�
(1) ����B�Ǵ�֧�ܵ���ƿ��������������ƿ��
(2) ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬�����������ų���������Ŀ���ǣ��ž�װ���ڵĿ�������ֹ������������������Ȼ�����2���رջ���1��3��
(3) �����̼��������Ӧ�������������Ͷ�����̼���䷴Ӧ��ѧ����ʽΪ2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2��+H2O��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ�����������ۣ���Ӧ������������Һ�л�������������壬��Ҫ���������������������������Ҫ�����������������ɣ����˺����������Ҵ�ϴ�ӣ���������Ϊ��bcad ��
(4) ���ݵ����غ㣬�����ϼ���+2���ߵ�+3������+6���͵�+3���ɵù�ϵΪ
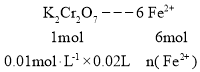
���n(Fe2+) = 1.2��10-3mol
������������Ĵ���Ϊ��![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ��Ƶķ��ȷ�Ӧ�Ĺ۲�װ�ã�

��ʵ������������£�
����ͼ��ʾ��ʵ��װ�����Ӻã�
����U�ι��ڼ���������īˮ(��Ʒ����Һ)����T�ιܻ���,ʹU�ι������ߵ�Һ�洦��ͬһˮƽ��,�ٹر�T�ιܻ�����
����ʢ��1.0g�����Ƶ�С�Թ������2 mL���ҵ�����ˮ���۲�����
�Իش�:
��1��ʵ��ǰ������е�һ��ʵ�������_______________��
��2��ʵ���й۲쵽��������______________________________________________________________��
��3��ʵ���з����Ļ�ѧ��Ӧ����ʽ:____________________________��
��4��˵��CaO��H2O��������Ca(OH)2������֮��Ĺ�ϵ:_______________________________________��
��5������ʵ����CaO����NaCl��ʵ�黹�ܷ�۲쵽��ͬ����?____(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O![]() H++OH����H��0������������ȷ���ǣ�������
H++OH����H��0������������ȷ���ǣ�������
A.��ˮ�м������������������ƣ�c��H+������Kw����
B.��ˮ�м��백ˮ��ƽ�������ƶ���c��OH��������
C.��ˮ�м�������ƣ�ƽ�������ƶ���c��H+������
D.��ˮ���ȣ�KW����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����X Ϊ�����ӽ���Ĥ�������й�˵����ȷ����

A. ��Ӧһ��ʱ�����װ�������ɵ�����������������
B. ��װ�������缫Ϊ�������缫��ӦʽΪFe-2e-= Fe2+
C. ��Ӧһ��ʱ���װ��������ͭ��ҺŨ�ȱ��ֲ���
D. ͨ��������һ��Ϊ�����������ĵ缫��ӦΪO2 - 4e- + 2H2O = 4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽɲ���CH3OH![]() CO+2H2�ķ�������ȡ�ߴ��ȵ�CO��H2���ҹ�������Աͨ�������ģ�⣬�о������ٻ���������״�����ķ�Ӧ������ͼ��ʾ�������������ٴ��������ϵ������ñ�ע������˵����ȷ���ǣ� ��
CO+2H2�ķ�������ȡ�ߴ��ȵ�CO��H2���ҹ�������Աͨ�������ģ�⣬�о������ٻ���������״�����ķ�Ӧ������ͼ��ʾ�������������ٴ��������ϵ������ñ�ע������˵����ȷ���ǣ� ��
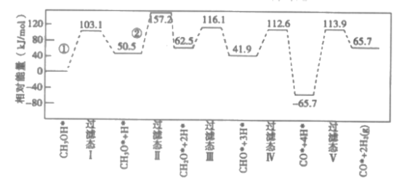
��֪���״�(CH3OH)���ⷴӦ�ĵ�һ�����̣������ֿ��ܷ�ʽ��
��ʽ��CH3OH*��CH3O*+H* Ea=+103.1 kJ��mol-1
��ʽ��CH3OH*��CH3*+OH* Eb=+249.3 kJ��mol-1
A.CH3OH*��CO*+2H2(g)����H>0
B.�٢ڶ�ΪO-H���Ķ��ѹ���
C.�ɻ��Eֵ�Ʋ⣬�״��ѽ������Ҫ�����ķ�ʽӦΪ��
D.�������εĻ�ѧ����ʽΪCHO*+3H*��CO*+4H*
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�ܷ��������ڻ�����������()
A.�����Cl2+H2![]() 2HCl
2HCl
B.��ȡþ��MgCl2(��Һ)![]() Mg+Cl2
Mg+Cl2
C.����ϩ��C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.���Ҵ���CH2=CH2+H2O![]() C2H5OH
C2H5OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H1����870.3 kJ/mol
��C(s)��O2(g)===CO2(g) ��H2����393.5 kJ/mol
��H2(g)��![]() O2(g)===H2O(l) ��H3����285.8 kJ/mol
O2(g)===H2O(l) ��H3����285.8 kJ/mol
��Ӧ��2C(s)��2H2(g)��O2(g)===CH3COOH(l)���ʱ�Ϊ
A.488.3 kJ/molB.��224.15 kJ/mol
C.��488.3 kJ/molD.244.15 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼����(2Na2CO3��3H2O2)�������ʾ���Na2CO3��H2O2 ��˫���ԣ����㷺��������������Ư��ɱ������ˮ�������������洦���Լ��߷��ӾۺϿ��Ƶȡ�
(1)Na ԭ�ӵĺ�������Ų�ʽΪ_____��O ԭ�Ӻ��� L ������_______��������ͬ�ĵ��ӣ�H2O2 �ĵ���ʽ��_____________________________________________
(2)���һ����ʵ�飬�Ƚ�O Ԫ������ͬ���������Ԫ�صķǽ�����ǿ��(��Ҫд��ʵ�鷽����ʵ������ͽ���)_____������ԭ�ӽṹ֪ʶ�������Ľ��۽��н���_____��
(3)��һ�����ӷ���ʽ��ʾ��̼������Һ�Լ��Ե�ԭ��________________________��
(4)�����������(![]() )ˮ������Σ�������ù�̼���Ƹ��Գ�����д�������Ӧ���£�
)ˮ������Σ�������ù�̼���Ƹ��Գ�����д�������Ӧ���£�
_____![]() +_______CO
+_______CO![]() +___H2O2��___MnCO3+___��+____OH-+____H2O
+___H2O2��___MnCO3+___��+____OH-+____H2O
��ȫ����ƽ������ѧ��Ӧ����ʽ_____����Ӧ�У���̼�������������_________�����ã����� 1L ��Mn 2000mg��L-1 �ĺ�����������ӵķ�ˮ��������Mn 1.2mg��L-1����ת�Ƶ�����Ϊ_____mol(���� 2 λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊȼ�ϣ��ڻ�ʯ��Դ�Ϳ�������Դʱ�ھ��й㷺��Ӧ��ǰ����
I. �״�����������ͺͲ�����Ϊ��ȼ��ȼ�ϡ�
��1�����͵���Ҫ�ɷ�֮һ������[C8H18(l)]����֪��25�桢101 kPaʱ��1 mol C8H18(l)��ȫȼ��������̬������̼��Һ̬ˮ���ų�5518 kJ�������÷�Ӧ���Ȼ�ѧ����ʽΪ______��
��2����֪��25�桢101 kPaʱ��CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) �� H��-726.5 kJ/mol����ͬ�����ļ״�������ֱ���ȫȼ��ʱ���ų������϶����______��
��3��ij�о��߷ֱ��Լ״���������ȼ�ϣ�ʵ�����ڷ������߸��ɹ�������£�����β����CO�İٷֺ����������ļ������ܵĹ�ϵ������ʾ��
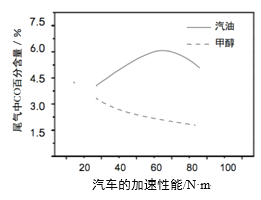
����ͼ��Ϣ��������������ȣ��״���Ϊȼ�ϵ��ŵ���______��
II. �״��ĺϳ�
��4����CO2(g)��H2(g)Ϊԭ�Ϻϳɼ״�����Ӧ�������仯����ͼ��ʾ��

�� ��ȫ��ͼ��ͼ��A��Ӧ����______��
�� �÷�Ӧ��Ҫ����ͭ��п����������������÷�Ӧ�Ħ�H______��������С�����䡱����
��5����֪�� CO(g)��1/2 O2(g) ==== CO2(g) ��H1��-283 kJ/mol
H2(g)��1/2 O2(g) ==== H2O(g) ��H2��-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ��H3��-676 kJ/mol
��CO(g)��H2(g)Ϊԭ�Ϻϳɼ״��ķ�ӦΪCO(g) + 2H2(g) ==== CH3OH(g) ���÷�Ӧ�Ħ�HΪ_____ kJ/mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com