
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
A.488.3 kJ/molB.-224.15 kJ/mol
C.-488.3 kJ/molD.244.15 kJ/mol
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法。
(1)图I是实验室制取蒸馏水的常用装置,图中明显的错误是_________________。


(2)仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量__________。
(4)图II装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是 ______________________;烧杯中还应盛有的物质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2X(g) ![]() Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
化情况如下表:

下列说法不正确的是( )
A. c>1.0 B. 实验2可能使用了催化剂
C. 实验3比实验2先达到化学平衡状态 D. 前10分钟,实验4的平均化学反应速率比实验1的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定次数 | 待测液体积/mL | 所消耗盐酸标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 25.00 | 1.50 | 21.40 |
2 | 25.00 | 2.50 | 22.60 |
3 | 25.00 | 0.60 | 23.20 |
(1)称量时,样品应放在________称量(选填字母序号)。
a.小烧杯中 b.洁净纸片上 c.托盘上
(2)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(3)判断滴定终点到达时的现象为_______________________________。
(4)若出现下列情况,测定结果偏高的是________(选填字母序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为________。(杂质不与酸反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C. 对于反应①C+CO2![]() 2CO(△H>0)和反应②N2+3H2
2CO(△H>0)和反应②N2+3H2![]() 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D. NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
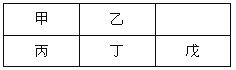
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼。
实验一:制备NH2Cl实验室制备一氯胺可用氨气与次氯酸钠反应,反应方程式为NH3+NaClO=NH2Cl+NaOH。某实验小组设计如下装置制备NH2Cl。
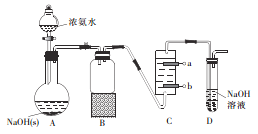
(1)B装置的作用为_________________
(2)C中盛装的是饱和食盐水,则惰性电极b应与电源_______极相连。
(3)先电解一段时间后,接下来的实验操作是______。
实验二:检测自来水中的一氯胺的含量.一氯胺是重要的水消毒剂,利用碘量法可以检测自来水中一氯胺的含量.其主要方法为:取已加入一氯胺的自来水20.00mL.加入过量的碘化钾溶液,充分反应后,用0.100 mol/L的Na2S2O3溶液进行滴定,达到终点时,消耗Na2S2O3溶液5.00 mL。
已知:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3- I3-![]() I2+I- I2+2S2O32-=2I-+S4O62-
I2+I- I2+2S2O32-=2I-+S4O62-
(4)滴定时用___作指示剂,判定达到滴定终点的现象是___________。
(5)该自来水中一氯胺的浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 硅晶体和二氧化硅晶体中都含共价键
B. 冰和干冰熔化时克服的作用力均为分子间作用力
C. 硫晶体和硫酸钠晶体均属于离子晶体
D. 氯气和四氯化碳分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com