
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
【答案】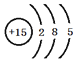 NH3>CH4 HClO4 NH4NO3 离子化合物 B
NH3>CH4 HClO4 NH4NO3 离子化合物 B
【解析】
①~⑩元素分别为H、C、N、O、Na、Mg、Al、P、S、Cl。
(1)⑧为P,核外电子排布分别为2、8、5。
(2)非金属越强,气态氢化物越稳定。
(3)③⑧⑩分别为N、P、Cl,根据非金属越强,其最高价含氧酸的酸性最强。
(4)③的气态氢化物NH3与③的最高价氧化物对应的水化物HNO3,两者反应生成铵盐。
(5)A.非金属强弱与元素单质的沸点无关;B.非金属越强,元素单质与氢气化合的越易;C.非金属越强,其最高价氧化物对应水化物的酸性越强,但氧无最高价含氧酸;D.通过单质与酸或碱反应的难易性不能判断非金属强弱。
(1)⑧为P,其原子结构示意图为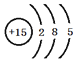 ;故答案为:
;故答案为: 。
。
(2)非金属越强,气态氢化物越稳定,②是C,③是N,非金属性N>C,因此气态氢化物稳定性的大小顺序:NH3>CH4;故答案为:NH3>CH4。
(3)③⑧⑩分别为N、P、Cl,根据非金属越强,其最高价含氧酸的酸性最强,因此最高价含氧酸的酸性最强的是HClO4;故答案为:HClO4。
(4)③的气态氢化物NH3与③的最高价氧化物对应的水化物HNO3,两者反应生成的盐是NH4NO3,它属于离子化合物;故答案为:NH4NO3;离子化合物。
(5)A.非金属强弱与元素单质的沸点无关,故A不符合题意;B.非金属越强,元素单质与氢气化合的越易,故B符合题意;C.非金属越强,其最高价氧化物对应水化物的酸性越强,但氧无最高价含氧酸,故C不符合题意;D.通过单质与酸或碱反应的难易性不能判断非金属强弱,故D不符合题意;综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据化学反应与热能的有关知识,填写下列空白:
(1)在Ba(OH)2·8H2O和NH4Cl晶体反应的演示实验中:反应物混合后需用玻璃棒迅速搅拌,其目的是____________,体现该反应为吸热反应的现象是烧杯变凉和________。
(2)下列过程中不一定释放能量的是____(请填编号)。
A.形成化学键 B.燃料燃烧 C.化合反应 D.葡萄糖在体内的氧化反应
E.酸碱中和 F.炸药爆炸
(3)已知:通常条件下,酸碱稀溶液中和生成1 mol水放出的热量为中和热。稀溶液中1 mol H2SO4和NaOH恰好反应时放出Q kJ热量,则其中和热为____kJ/mol。
(4)已知H2和O2反应放热,且断开1 mol H-H、1 mol O=O、 1 mol O-H键需吸收的能量分别为Q1、Q2、Q3 kJ,由此可以推知下列关正确的是___(填编号)。
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.2Q1+Q2<4Q3 D.2Q1+Q2<2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
A.488.3 kJ/molB.-224.15 kJ/mol
C.-488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
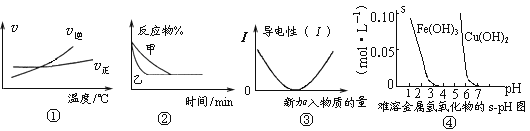
A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4![]() Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
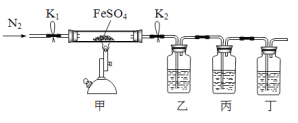
A. 乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液
B. 实验开始时,先打开K1和K2,缓缓通入N2一段时间,再点燃酒精喷灯加热
C. 若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性
D. 为了检验甲中残留固体中含有Fe3+,取少量固体加入稀硝酸溶解,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钡氧化物二次电池。电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 该电池充电时,锂极与外电源的负极相连
B. 该电池放电时,Li+向负极移动
C. 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D. 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com