
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
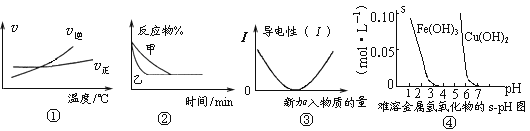
A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
【答案】D
【解析】
A项,交点后,随着温度升高,逆反应增加的程度大于正反应增加的程度,正反应为放热反应,故A项错误;
B项,从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大;另外,根据反应方程式可以看出,物质D为固体,则增大压强平衡向正反应方向移动,反应物的含量减小,而图中达到平衡时反应物的浓度在两种不同压强下相同,是不符合实际的,故B错误;
C项,乙酸是弱酸,不能完全电离,乙酸溶液的导电性不如等物质的量的强电解质溶液,乙酸溶液中加入氨气后生成强电解质导电性增强,完全中和之后氨气继续溶入水中形成的氨水也是弱电解质,溶液导电性缓慢增大,与图上曲线显示不符,故C项错误。
D项,Fe3+在pH在4左右沉淀完全而Cu2+几乎不沉淀,向溶液中加入适量CuO可调节溶液pH值使Fe3+沉淀完全被除去,故D项正确;
综上所述,本题正确答案为D。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汞阴极法电解饱和食盐水制取NaOH的原理如图所示。下列说法不正确的是

A.电解室中反应的化学方程式为 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.解汞室中反应的离子方程式为 2Na+2H2O=2Na++2OH-+H2↑
C.该方法的缺点是挥发出的汞蒸气会造成环境污染
D.电解室与解汞室产生的气体可用于制取盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C. 对于反应①C+CO2![]() 2CO(△H>0)和反应②N2+3H2
2CO(△H>0)和反应②N2+3H2![]() 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D. NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。试回答下列问题:
CO2(g)+H2(g) △H<0。试回答下列问题:
(1)若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L—1,达到平衡时CO的转化率为60%,则平衡常数K=_____________,此时水蒸气的转化率为______________。
(2)在相同温度下,若起始时c(CO)=1mol·L—1,c(H2O)=2mol·L—1,反应进行一段时间后,测得H2的浓度为0.5mol·L—1,则此时该反应是否达到平衡状态_____(填“是”或“否”),此时v(正)__v(逆)(填“>”“<”或“=”)。
(3)若降低温度,该反应的K值将___________,化学反应速率将______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
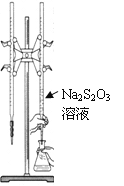
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com