
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
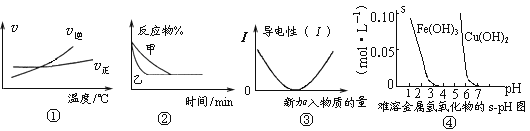
A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如下图所示装置以制备E3B2,装置①用于制备B单质。

下列说法正确的是
A. E与B的简单离子的电子层结构相同,且简单离子半径B<E
B. ④⑥中依次盛装的试剂可以是NaOH溶液、碱石灰
C. D元素形成的单质与A2C不反应
D. 实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管口湿润的红色石蕊试纸变蓝的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是

A. 利用甲装置,验证SO2或H2SO3具有氧化性
B. 利用乙装置,验证元素的非金属性:C1>C>Si
C. 利用丙装置,进行NH3的干燥、收集、尾气处理
D. 利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钡氧化物二次电池。电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 该电池充电时,锂极与外电源的负极相连
B. 该电池放电时,Li+向负极移动
C. 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D. 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,2NO+Na2O2====2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(加热装置及部分夹持装置已略去)

回答下列问题:
(1)A装置中反应的化学方程式为__________________________________________。
(2)B装置的作用是_________________________________________________。
(3)充分反应后,C中生成的固体除NaNO2外,还可能生成_________(填化学式),为避免杂质的生成,应在B、C之间加一个为_________装置,该装置和所盛放试剂的名称分别是____________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为_________( (填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式______________________
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(3)常温下,向50 mL 0.005 mol·L1的Cr2(SO4)3溶液中加入0.24 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(5)利用图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,Na2CrO4生成Na2Cr2O7的离子方程式_______________________。若左侧电极产生标况下2.24L的气体,则通过交换膜的钠离子的数目为___________________
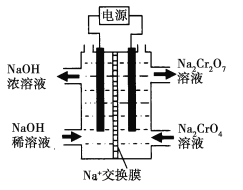 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%-5%的D,其转化关系如下图所示。
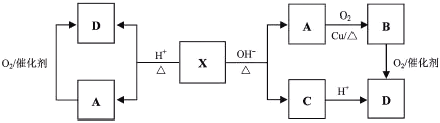
请回答:
(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)下列说法不正确的是________。
A.A+D→X的反应属于取代反应
B.除去X中少量D杂质可用饱和Na2CO3溶液
C.A与金属钠反应比水与金属钠反应要剧烈得多
D.等物质的量的A、B、D完全燃烧消耗O2的量依次减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com