
【题目】过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2 的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
(1)Na 原子的核外电子排布式为_____,O 原子核外 L 层上有_______种能量不同的电子,H2O2 的电子式是_____________________________________________
(2)设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论)_____;并用原子结构知识对作出的结论进行解释_____。
(3)用一个离子方程式表示过碳酸钠溶液显碱性的原因________________________。
(4)高锰酸根离子(![]() )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
_____![]() +_______CO
+_______CO![]() +___H2O2→___MnCO3+___□+____OH-+____H2O
+___H2O2→___MnCO3+___□+____OH-+____H2O
补全并配平上述化学反应过程式_____;反应中,过碳酸钠起沉淀剂和_________剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1,则转移电子数为_____mol(保留 2 位小数)
【答案】1s22s22p63s1 2 ![]() 向H2S的水溶液中通入空气,溶液变浑浊,说明非金属性:O>S(合理即可) O原子和S原子最外层电子数相同,S原子的电子层数比O原子多,半径比O原子大,S原子得电子能力比O原子难 CO32+H2OHCO3+OH 2MnO4-+2CO32-+5H2O2=2MnCO3+5O2↑+6OH-+2H2O 还原 0.18
向H2S的水溶液中通入空气,溶液变浑浊,说明非金属性:O>S(合理即可) O原子和S原子最外层电子数相同,S原子的电子层数比O原子多,半径比O原子大,S原子得电子能力比O原子难 CO32+H2OHCO3+OH 2MnO4-+2CO32-+5H2O2=2MnCO3+5O2↑+6OH-+2H2O 还原 0.18
【解析】
(1)Na为11号元素,根据构造原理书写钠原子的核外电子排布式;O 原子核外 L 层上有2s和2p两个能级;H2O2 是共价化合物,含有O-H极性共价键和O-O非极性共价键;
(2)与O元素同主族短周期元素为S元素,元素的非金属性越强,其单质的氧化性越强,氧化剂的氧化性大于氧化产物的氧化性来设计实验确定非金属性强弱;S原子的电子层数比O原子多,半径比O原子大,S原子得电子能力比O原子难;
(3)碳酸钠属于强碱弱酸盐,碳酸离子在溶液中发生水解使溶液呈碱性;
(4)根据反应,可知Mn元素由+7价变为+2价,化合价降低5,H2O2中O元素由-1价变为-2价,化合价降低1,氧化还原反应中必然有化合价升高的元素,根据反应分析,应为双氧水的O元素化合价升高,变为O2,结合电荷守恒和得失电子守恒配平方程式;再结合方程式计算电子转移数目。
(1)Na为11号元素,核外有11个电子,原子的核外电子排布式为1s22s22p63s1,O 原子核外 L 层上有2s和2p两个能级,则有2种能量不同的电子,H2O2 是共价化合物,含有O-H极性共价键和O-O非极性共价键,电子式是![]() ;
;
(2)与O元素同主族短周期元素为S元素,元素的非金属性越强,其单质的氧化性越强,可以利用氧化还原反应,氧化剂的氧化性大于氧化产物的氧化性,来确定非金属性强弱,实验方法为:向H2S的水溶液中通入空气,溶液变浑浊,空气中的氧气与硫化氢发生氧化还原反应生成硫沉淀,反应方程式为:H2S+O2=S↓+H2O,反应中O2为氧化剂,S单质为氧化产物,氧化剂的氧化性强于氧化产物的氧化性,则氧化性O2>S,则说明非金属性:O>S(合理即可);从二者的结构分析,O原子和S原子最外层电子数相同,S原子的电子层数比O原子多,半径比O原子大,S原子得电子能力比O原子难,所以S元素的非金属性比O元素弱;
(3)碳酸钠属于强碱弱酸盐,碳酸离子在溶液中发生水解生成碳酸氢根离子和氢氧根离子,使溶液呈碱性,离子反应为CO32+H2OHCO3+OH;
(4)根据反应,可知Mn元素由+7价变为+2价,化合价降低5,H2O2中O元素由-1价变为-2价,化合价降低1,氧化还原反应中必然有化合价升高的元素,根据反应分析,应为双氧水的O元素化合价升高,变为O2,结合电荷守恒和得失电子守恒,该氧化还原反应配平为2MnO4-+2CO32-+5H2O2=2MnCO3+5O2↑+6OH-+2H2O;反应中,过碳酸钠的化学式为2Na2CO3·3H2O2,在反应中起沉淀剂和还原剂作用;若将 1L 含Mn 2000mg·L-1 的高猛废水处理至含Mn 1.2mg·L-1,Mn元素的质量变化=1L×(2000mg·L-1-1.2mg·L-1)×10-3=1.9988g,被处理的Mn元素物质的量为![]() ≈0.036mol,根据原子守恒,MnO4-的物质的量为0.036mol,则转移电子数为0.36×(7-2)mol=0.18mol。
≈0.036mol,根据原子守恒,MnO4-的物质的量为0.036mol,则转移电子数为0.36×(7-2)mol=0.18mol。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
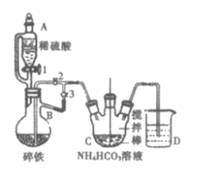
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性:Cl2>IO3->Fe3+>I2,则对实验结果分析或预测正确的是( )
A.加碘食盐溶液中滴入少量白醋和淀粉 KI 溶液,溶液变蓝色,说明可能是 IO![]()
B.加碘食盐溶液中加入过量氯水后加淀粉,溶液不变蓝色,说明不可能是 I-
C.FeI2 溶液中滴加少量氯水,溶液中一定有 Fe3+生成
D.FeCl2 溶液中滴加足量碘水和 KSCN 溶液,溶液一定变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生反应时,物质的量随时间变化的关系曲线如图所示,求:
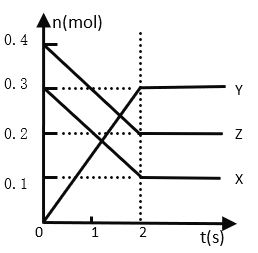
(1)前2 s内X的反应速率_____________。
(2)化学反应方程式___________________。
(3)Z的平衡转化率____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
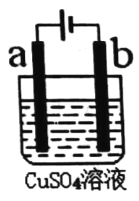
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
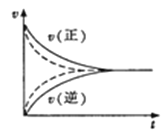
【题目】下列关于反应速率的说法中,正确的是
A.决定化学反应速率的因素是反应物本身的性质
B.对反应C(s)+CO2(g)![]() 2CO(g),其他条件不变时,增加C的量能使反应速率增大
2CO(g),其他条件不变时,增加C的量能使反应速率增大
C.其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.如图实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
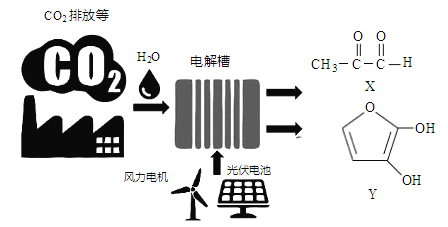
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
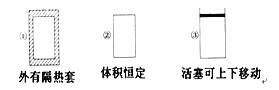
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com