
����Ŀ�����й��ڷ�Ӧ���ʵ�˵���У���ȷ����
A.������ѧ��Ӧ���ʵ������Ƿ�Ӧ�ﱾ��������
B.�Է�ӦC(s)��CO2(g)![]() 2CO(g)��������������ʱ������C������ʹ��Ӧ��������
2CO(g)��������������ʱ������C������ʹ��Ӧ��������
C.����������ͬʱ����Ӧ�¶����ߣ��������ȷ�Ӧ����Ӧ���ʼӿ죬���ڷ��ȷ�Ӧ����Ӧ���ʼ���
D.��ͼʵ�ߡ����߷ֱ��ʾij���淴Ӧδʹ�ô�����ʹ�ô����������淴Ӧ������ʱ��ı仯
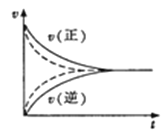
���𰸡�A
��������
A.��Ӧ�ﱾ���������Ǿ�����Ӧ���ʵ���Ҫ���أ����ҩ��ը��ʳ�︯�ܷ�Ӧ�Ŀ��������ɷ�Ӧ�ﱾ������������������A��ȷ��
B. CΪ��̬��Ũ��Ϊ��ֵ������C��������Ũ�ȵı仯��Ϊ0�����Է�Ӧ���ʲ��䣬��B����
C.�¶����ߣ�����������ӣ���Ч��ײ�Ĵ������ӣ����۷�Ӧ�����Ȼ��Ƿ��ȣ���Ӧ���ʶ��ӿ죬��C����
D.ʹ�ô�����ѧ��Ӧ���ʼӿ죬��������Ӧ���ʵ�������ʵ�ߵ��Ϸ�����D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O![]() H++OH����H��0������������ȷ���ǣ�������
H++OH����H��0������������ȷ���ǣ�������
A.��ˮ�м������������������ƣ�c��H+������Kw����
B.��ˮ�м��백ˮ��ƽ�������ƶ���c��OH��������
C.��ˮ�м�������ƣ�ƽ�������ƶ���c��H+������
D.��ˮ���ȣ�KW����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H1����870.3 kJ/mol
��C(s)��O2(g)===CO2(g) ��H2����393.5 kJ/mol
��H2(g)��![]() O2(g)===H2O(l) ��H3����285.8 kJ/mol
O2(g)===H2O(l) ��H3����285.8 kJ/mol
��Ӧ��2C(s)��2H2(g)��O2(g)===CH3COOH(l)���ʱ�Ϊ
A.488.3 kJ/molB.��224.15 kJ/mol
C.��488.3 kJ/molD.244.15 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼����(2Na2CO3��3H2O2)�������ʾ���Na2CO3��H2O2 ��˫���ԣ����㷺��������������Ư��ɱ������ˮ�������������洦���Լ��߷��ӾۺϿ��Ƶȡ�
(1)Na ԭ�ӵĺ�������Ų�ʽΪ_____��O ԭ�Ӻ��� L ������_______��������ͬ�ĵ��ӣ�H2O2 �ĵ���ʽ��_____________________________________________
(2)���һ����ʵ�飬�Ƚ�O Ԫ������ͬ���������Ԫ�صķǽ�����ǿ��(��Ҫд��ʵ�鷽����ʵ������ͽ���)_____������ԭ�ӽṹ֪ʶ�������Ľ��۽��н���_____��
(3)��һ�����ӷ���ʽ��ʾ��̼������Һ�Լ��Ե�ԭ��________________________��
(4)�����������(![]() )ˮ������Σ�������ù�̼���Ƹ��Գ�����д�������Ӧ���£�
)ˮ������Σ�������ù�̼���Ƹ��Գ�����д�������Ӧ���£�
_____![]() +_______CO
+_______CO![]() +___H2O2��___MnCO3+___��+____OH-+____H2O
+___H2O2��___MnCO3+___��+____OH-+____H2O
��ȫ����ƽ������ѧ��Ӧ����ʽ_____����Ӧ�У���̼�������������_________�����ã����� 1L ��Mn 2000mg��L-1 �ĺ�����������ӵķ�ˮ��������Mn 1.2mg��L-1����ת�Ƶ�����Ϊ_____mol(���� 2 λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ��ǣ� ��
��![]()
��![]()
��![]()
��![]()
A.�٢�B.�٢�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�ij��̬������ϩ��(��һ��˫��)�Ļ������2.24 L��ȫȼ�պ����������建��ͨ��Ũ���ᣬŨ��������4.05 g��ʣ������ͨ����ʯ�ң���ʯ������6.60 g������ȡ2.24 L��״���µĸû�����壬����ͨ���������ˮ�У���ˮ����1.05 g��
(1)ȷ����������������������_______��
(2)���������������������������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊȼ�ϣ��ڻ�ʯ��Դ�Ϳ�������Դʱ�ھ��й㷺��Ӧ��ǰ����
I. �״�����������ͺͲ�����Ϊ��ȼ��ȼ�ϡ�
��1�����͵���Ҫ�ɷ�֮һ������[C8H18(l)]����֪��25�桢101 kPaʱ��1 mol C8H18(l)��ȫȼ��������̬������̼��Һ̬ˮ���ų�5518 kJ�������÷�Ӧ���Ȼ�ѧ����ʽΪ______��
��2����֪��25�桢101 kPaʱ��CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) �� H��-726.5 kJ/mol����ͬ�����ļ״�������ֱ���ȫȼ��ʱ���ų������϶����______��
��3��ij�о��߷ֱ��Լ״���������ȼ�ϣ�ʵ�����ڷ������߸��ɹ�������£�����β����CO�İٷֺ����������ļ������ܵĹ�ϵ������ʾ��
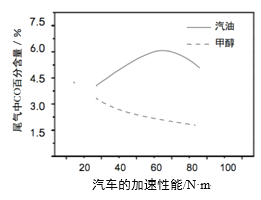
����ͼ��Ϣ��������������ȣ��״���Ϊȼ�ϵ��ŵ���______��
II. �״��ĺϳ�
��4����CO2(g)��H2(g)Ϊԭ�Ϻϳɼ״�����Ӧ�������仯����ͼ��ʾ��

�� ��ȫ��ͼ��ͼ��A��Ӧ����______��
�� �÷�Ӧ��Ҫ����ͭ��п����������������÷�Ӧ�Ħ�H______��������С�����䡱����
��5����֪�� CO(g)��1/2 O2(g) ==== CO2(g) ��H1��-283 kJ/mol
H2(g)��1/2 O2(g) ==== H2O(g) ��H2��-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ��H3��-676 kJ/mol
��CO(g)��H2(g)Ϊԭ�Ϻϳɼ״��ķ�ӦΪCO(g) + 2H2(g) ==== CH3OH(g) ���÷�Ӧ�Ħ�HΪ_____ kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L�ĺ����ܱ������з�����ӦxA(g)+yB(g)![]() zC(g)��ͼ1��ʾ200��ʱ������A��B��C�����ʵ�����ʱ��ı仯��ϵ��ͼ2��ʾ��ͬ�¶��´ﵽƽ��ʱC�������������ʼ
zC(g)��ͼ1��ʾ200��ʱ������A��B��C�����ʵ�����ʱ��ı仯��ϵ��ͼ2��ʾ��ͬ�¶��´ﵽƽ��ʱC�������������ʼ![]() �ı仯��ϵ�������н�����ȷ���ǣ� ��
�ı仯��ϵ�������н�����ȷ���ǣ� ��
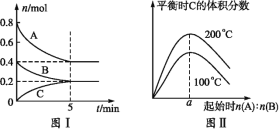
A.200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)=0.04mol��L-1��min-1
B.��ͼ2��֪��ӦxA(g)+yB(g)![]() zC(g)����H<0����a=2
zC(g)����H<0����a=2
C.����ͼ1��ʾ��ƽ��״̬�£�������ϵ�г���He�����´ﵽƽ��ǰv(��)>v(��)
D.200��ʱ���������г���2molA��1molB���ﵽƽ��ʱ��A���������С��0.5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com