
����Ŀ����ѧƽ�ⳣ��K����ֵ��С�Ǻ�����ѧ��Ӧ���г̶ȵı�־���ڳ����£�ijЩ��Ӧ��ƽ�ⳣ����ֵ���£�
2NO��g��![]() N2��g����O2��g����K1��1��1030
N2��g����O2��g����K1��1��1030
2H2��g����O2��g��![]() 2H2O��g����K2��2��1081
2H2O��g����K2��2��1081
2CO2��g��![]() 2CO��g����O2��g����K3��4��10��92
2CO��g����O2��g����K3��4��10��92
����˵������ȷ���ǣ�������
A.�����£�ˮ�ֽ����O2����ʱƽ�ⳣ����ֵԼΪ5��10��80
B.�����£����ֽ�ų�O2����ˮ
C.K3��![]()
D.���϶�����ȷ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�[��ѧ����ѡ��5���л���ѧ����]
�����б��������������E�뻯����H��Cr-Ni���¿��Է���ż����Ӧ���ϳ�һ�ֶ�����ŵĻ�����Y����ϳ�·�����£�
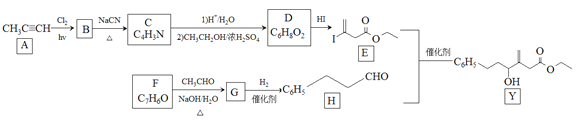
��֪��![]()
�ش��������⣺
��1��A�Ļ�ѧ������________________��
��2��BΪ���ȴ�������B����C�Ļ�ѧ����ʽΪ________________��
��3����A����B��G����H�ķ�Ӧ���ͷֱ���________________��________________��
��4��D�Ľṹ��ʽΪ________________��
��5��Y�к��������ŵ�����Ϊ________________��
��6��E��F��Cr-Ni����Ҳ���Է���ż����Ӧ������Ľṹ��ʽΪ________________��
��7��X��D��Ϊͬ���칹�壬�Ҿ�����ȫ��ͬ�����š�X�ĺ˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ3��3��2��д��3�ַ�������������X�Ľṹ��ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ýṹ��ԭ�����ͻ�ѧ��Ӧ�����͡��ȡ����ʺ���������Ҫ�Ļ�ѧѧ��˼ά���ش��������⣺
��1���ù����������Cr(��)�ķ�Ӧ��Cr2O72-+4H2O2+2H+=2CrO5+5H2O��CrO5�ṹʽΪ![]() ���÷�Ӧ�Ƿ�Ϊ������ԭ��Ӧ��___����������������������
���÷�Ӧ�Ƿ�Ϊ������ԭ��Ӧ��___����������������������
��2����֪��
2H2(g)+O2(g)=2H2O(l) ��H=-571.6kJ��mol-1
H2(g)+O2(g)=H2O2(l) ��H=-187.8kJ��mol-1
2H2O2(l)=2H2O(l)+ O2(g) ��H=___kJ��mol-1��
��3��һ�������£�H2O2�ֽ�ʱ��c(H2O2)��t�仯��ͼ��ʾ����֪�÷�Ӧ��˲ʱ���ʿɱ�ʾΪv(H2O2)=k��cn(H2O2)��kΪ���ʳ�����

��0-20min�ڣ�v(H2O2)=___��
�ھ�ͼ������n=___��
������������ͬ��ʹ�û��Ը��ߵĴ���������˵����ȷ����___�����ţ���
A.v(H2O2)���� B.k���� C.��H��С D.Ea����ܣ�����
��4�������ѹpi=p����xi�����ʵ���������������50�桢��ѹ101kPa����������CuSO4��5H2O��NaHCO3����һ���ܱ������У��ٳ����ѳ�ȥCO2�ĸ������������ֻ�������·�Ӧ����ƽ��ʱ���߷ֽ�����ʵ�����Ϊ2��1��
CuSO4��5H2O(s)CuSO4��3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) Kp2
��ƽ��ʱ![]() =___��Kp2=___��
=___��Kp2=___��
��ƽ�������ѹΪ101kPa�ij�ʪ����[����p(H2O)=8kPa��p(CO2)=0.4kPa]�滻�����е����壬50���´ﵽ��ƽ�⡣������CuSO4��5H2O��������___����������������������������������ͬ����NaHCO3������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦX��g��+Y��g�� ![]() 2Z��g����H��0��һ�������£���Ӧ��Y��ת�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����ʹ����a��Ϊ����b�ɲ�ȡ�Ĵ�ʩ��
2Z��g����H��0��һ�������£���Ӧ��Y��ת�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����ʹ����a��Ϊ����b�ɲ�ȡ�Ĵ�ʩ��
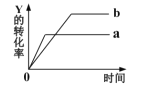
A.�������B.�����¶�C.����ѹǿD.����Y��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2 mol A��2 mol B�����2 L���ܱ������У��������·�Ӧ��2A��g����3B��g��![]() 2C��g����zD��g����2 s��A��ת����Ϊ50%�����v��D����0.25 mol��L��1��s��1�������ƶ���ȷ���ǣ�������
2C��g����zD��g����2 s��A��ת����Ϊ50%�����v��D����0.25 mol��L��1��s��1�������ƶ���ȷ���ǣ�������
A.v��C����v��D����0.25 mol��L��1��s��1
B.z��3
C.B��ת����Ϊ25%
D.C���������Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡˮú���ķ�ӦΪC(s)��H2O(g) ![]() CO(g)��H2(g)����H>0����һ�������´ﵽ��ѧƽ�����ʱ��ΪtʱͻȻ�ı���������Ӧ���ʵı仯��ͼ��ʾ����tʱ���ı��������(��)
CO(g)��H2(g)����H>0����һ�������´ﵽ��ѧƽ�����ʱ��ΪtʱͻȻ�ı���������Ӧ���ʵı仯��ͼ��ʾ����tʱ���ı��������(��)

A����ѹ B������ C������ˮ����Ũ�� D������̼�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2��)������ȡ���ֻ����Լ�������Ϊ�����ܾ�����Ȼ��ܾ�����Ʊ����̡�
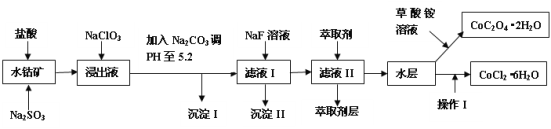
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+��Mg2+��Ca2+�ȡ�
�ڳ���I��ֻ�������ֳ�����
�۲��������ӵ�����������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�ش��������⣺
(1)����������Co2O3������Ӧ�����ӷ���ʽΪ___��
(2)�ڽ���Һ�м���NaClO3��������___��
(3)����Na2CO3��pH��5.2��Ŀ����___����ȡ���㺬��Ԫ�أ������II����Ҫ�ɷ�___��
(4)����I�а�������Ũ���Ĺ��̣�������Ũ��֮ǰӦ������Һ�м���_______(���Լ�����)��
(5)Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ���������������ữ����������Һ�����ˡ�ϴ�ӡ�������ء�ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O������������100%����ԭ�������___���ش�һ��ԭ�ɣ���
(6)��5.49 g�����ܾ���(CoC2O4��2H2O)���ڿ����м��ȣ����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������±���
�¶ȷ�Χ/�� | ��������/g |
150��210 | 4.41 |
290��320 | 2.41 |
���ⶨ���������ȹ��̣�ֻ����ˮ������CO2���壬����150�桫210���¶ȷ�Χ�ų�������������_______��290�桫320���¶ȷ�Χ��ʣ��Ĺ������ʻ�ѧʽΪ________��
����֪��CoC2O4��2H2O��Ħ������Ϊ183 g/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽ��ͼ�����й��ڷ�֦���������ȷ����
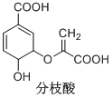
A.��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
B.�����к���4�ֹ����ţ�3������̼ԭ��
C.�ɷ�����ȥ��Ӧ���γɷ����廯����
D.1mol��֦��������3mol NaOH�����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������뻯ѧƽ���ƶ�������ء�Ѫ�쵰��(Hb)��O2��ϳ�����Ѫ�쵰��(Hb(O2))�Ĺ��̿ɱ�ʾΪ��Hb��O2(g)![]() Hb(O2)������˵����ȷ����
Hb(O2)������˵����ȷ����
A.�������ߣ�O2��Hb��ϸ��죬��Ӧ��ƽ�ⳣ������
B.�������ʿ�����ƽ�������ƶ�
C.CO�ﵽһ��Ũ����ʹ���ж�������Ϊ���HbʹHb(O2)�ֽ���������
D.��ѹ��������CO�ж���ԭ����ʹƽ��Hb(CO)��O2(g)![]() Hb(O2)��CO(g)����
Hb(O2)��CO(g)����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com