
【题目】用结构和原理阐释化学反应的类型、限度、速率和历程是重要的化学学科思维。回答下列问题:
(1)用过氧化氢检验Cr(Ⅵ)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5结构式为![]() ,该反应是否为氧化还原反应?___(填“是”或“否”)。
,该反应是否为氧化还原反应?___(填“是”或“否”)。
(2)已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+O2(g)=H2O2(l) △H=-187.8kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) △H=___kJ·mol-1。
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。

①0-20min内,v(H2O2)=___。
②据图分析,n=___。
③其它条件相同,使用活性更高的催化剂,下列说法正确的是___(填标号)。
A.v(H2O2)增大 B.k增大 C.△H减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时![]() =___,Kp2=___。
=___,Kp2=___。
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将___(填“增加”“减少”或“不变”,下同),NaHCO3质量将___。
【答案】否 -196 0.020mol/(Lmin) 1 AB 9 4(kPa)2 增加 减少
【解析】
(1)有化合价发生变化的反应为氧化还原反应,根据CrO5结构式为![]() 分析反应中是否有化合价变化;
分析反应中是否有化合价变化;
(2)根据盖斯定律解答;
(3)①0-20min内,根据图像,利用v=![]() 计算v(H2O2);
计算v(H2O2);
②已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),根据图示,每间隔20分钟,双氧水的浓度变为原来的一半,则速率也变为原来的二分之一;
③催化剂能加快反应速率,降低活化能,不能改变焓变;
(4)①利用相同条件下物质的量之比等于压强之比,结合![]() 求解;
求解;
②利用Qp与Kp的大小关系解答;
(1)由CrO5的结构式可知存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键中O为-2价,Cr元素化合价为+6价,反应前后元素化合价没有发生变化不是氧化还原反应;
(2) 已知:①2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ·mol-1
②H2(g)+O2(g)=H2O2(l) △H = -187.8kJ·mol-1
则根据盖斯定律,①-②×2可得,2H2O2(l)=2H2O(l)+ O2(g) △H = -196kJ·mol-1;
(3)①0-20min内,根据图像,H2O2的浓度变化量=0.4 mol/L,v(H2O2)=![]() =0.020mol/(Lmin);
=0.020mol/(Lmin);
②根据图示,每间隔20分钟,双氧水的浓度变为原来的一半,则速率也变为原来的二分之一,已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),20分钟时的双氧水瞬时速率v(H2O2)20min= k×(0.4)n,40分钟时的双氧水瞬时速率v(H2O2)40min= k×(0.2)n, ,则(0.4)n=2×(0.2)n,则n=1;
,则(0.4)n=2×(0.2)n,则n=1;
③A.催化剂能加快反应速率,故v(H2O2)增大,故A正确;
B.催化剂能加快反应速率,则速率常数k增大,故B正确;
C.催化剂不改变反应热(焓变),则△H不变,故C错误;
D.催化剂可降低反应的活化能,则Ea(活化能)减小,故D错误;
答案选AB;
(4)①假设只发生以下反应,达平衡时两者分解的物质的量比为2:1,设发生分解的CuSO4·5H2O的物质的量为2mol,根据反应CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g),则生成水蒸气的物质的量为4mol,设发生分解2NaHCO3的物质的量为1mol,根据反应2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g),则生成的水蒸气和二氧化碳分别为0.5mol,利用相同条件下物质的量之比等于压强之比,![]() =
=![]() =9结合
=9结合![]() =9,则Kp2=
=9,则Kp2=![]() =
=![]() =4(kPa)2求解;
=4(kPa)2求解;
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。对于反应CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g),Qp1=(8kPa)2=64(kPa)2>Kp1,平衡逆向进行,容器内CuSO4·5H2O的质量将增加;对于反应2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g),Qp2= p(H2O) p(CO2)=3.2(kPa)2<Kp2,平衡正向进行,容器内NaHCO3质量将减小。


科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是
A.分子式为C4H8O2的酯有4种结构
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种
C.丙烯分子中最多有7个原子共平面
D.乙烯和溴的四氯化碳溶液反应生成1,2二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() +HNO3
+HNO3![]() +H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是( )
+H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是( )
A.配制混酸 B.水浴加热
B.水浴加热
C.洗涤后分液 D.蒸馏提纯
D.蒸馏提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应2C(s)+O2(g)![]() 2CO(g);2CO(g)+O2(g)
2CO(g);2CO(g)+O2(g)![]() 2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
A.56 g CO和32 g O2所具有的总能量之和大于88 g CO2所具有的总能量
B.12 g C所具有的能量一定高于28 g CO所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将两份质量相等的碳完全燃烧,生成CO2的反应比生成CO的反应放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟西汀G是一种治疗抑郁性精神障碍的药物,其一种合成路线如图:

已知:LiAIH4是强还原剂,不仅能还原醛、酮,还能还原酯,但成本较高。
回答下列问题:
(1)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出D的结构简式,用星号(*)标出D中的手性碳___。
(2)④的反应类型是___。
(3)C的结构简式为___。
(4)G的分子式为___。
(5)反应⑤的化学方程式为___。
(6)已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应。M分子的苯环上有3个取代基,其中两个相同。符合条件的M有__种。
(7) 也是一种生产氟西汀的中间体,设计以
也是一种生产氟西汀的中间体,设计以![]() 和
和![]() 为主要原料制备它的合成路线___(无机试剂任选)。
为主要原料制备它的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
A.常温下,水分解产生O2,此时平衡常数的值约为5×10-80
B.常温下,最易分解放出O2的是水
C.K3=![]()
D.以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
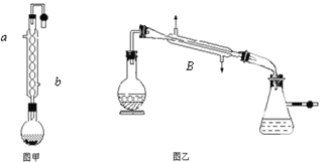
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
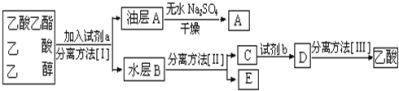
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com