
【题目】氟西汀G是一种治疗抑郁性精神障碍的药物,其一种合成路线如图:

已知:LiAIH4是强还原剂,不仅能还原醛、酮,还能还原酯,但成本较高。
回答下列问题:
(1)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出D的结构简式,用星号(*)标出D中的手性碳___。
(2)④的反应类型是___。
(3)C的结构简式为___。
(4)G的分子式为___。
(5)反应⑤的化学方程式为___。
(6)已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应。M分子的苯环上有3个取代基,其中两个相同。符合条件的M有__种。
(7) 也是一种生产氟西汀的中间体,设计以
也是一种生产氟西汀的中间体,设计以![]() 和
和![]() 为主要原料制备它的合成路线___(无机试剂任选)。
为主要原料制备它的合成路线___(无机试剂任选)。
【答案】 取代反应
取代反应  C17H18NOF3
C17H18NOF3 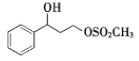 +CH3NH2→
+CH3NH2→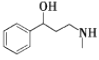 +CH3SO2OH 12
+CH3SO2OH 12 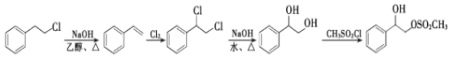
【解析】
B在催化剂作用下与氢气发生加成反应生成C,C与氢化铝锂反应生成D,根据D和B的结构简式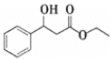 ,D与CH3SO2Cl发生取代反应生成E,E与CH3NH2发生取代反应生成F,F与
,D与CH3SO2Cl发生取代反应生成E,E与CH3NH2发生取代反应生成F,F与![]() 在氢化钠作用下发生取代反应生成G。根据G和E的结构简式,可得F的结构简式为
在氢化钠作用下发生取代反应生成G。根据G和E的结构简式,可得F的结构简式为 ,据此分析解答。
,据此分析解答。
(1)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。D中的手性碳位置为 ;
;
(2)根据分析,④的反应类型是取代反应;
(3)根据分析,C的结构简式为 ;
;
(4)G的分子式为C17H18NOF3;
(5)反应⑤为E与CH3NH2发生取代反应生成F化学方程式为: +CH3NH2→
+CH3NH2→ +CH3SO2OH;
+CH3SO2OH;
(6)D的结构简式为![]() ,已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应,说明分子中有酚羟基。M分子的苯环上有3个取代基,其中两个相同,即苯环上有两个羟基和一个-C3H7原子团。-C3H7原子团的结构式共有-CH2CH2CH3和-C(CH3)2两种结构,同分异构体数目分析如下:若羟基的位置结构为
,已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应,说明分子中有酚羟基。M分子的苯环上有3个取代基,其中两个相同,即苯环上有两个羟基和一个-C3H7原子团。-C3H7原子团的结构式共有-CH2CH2CH3和-C(CH3)2两种结构,同分异构体数目分析如下:若羟基的位置结构为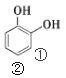 ,同分异构体的数量为2×2=4种,若羟基的位置结构为
,同分异构体的数量为2×2=4种,若羟基的位置结构为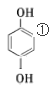 ,同分异构体的数量为1×2=2种,若羟基的位置结构为
,同分异构体的数量为1×2=2种,若羟基的位置结构为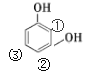 ,同分异构体的数量为3×2=6种;则符合条件的M有12种;
,同分异构体的数量为3×2=6种;则符合条件的M有12种;
(7) 在加热条件下,![]() 在氢氧化钠醇溶液中发生消去反应生成
在氢氧化钠醇溶液中发生消去反应生成![]() ,
,![]() 和氯气发生加成反应生成
和氯气发生加成反应生成![]() ,加热条件下,
,加热条件下,![]() 与氢氧化钠溶液发生取代反应生成
与氢氧化钠溶液发生取代反应生成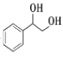 ,
, 与CH3SO2Cl发生取代反应生成
与CH3SO2Cl发生取代反应生成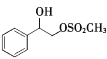 ,合成路线为:
,合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向Ca(ClO)2溶液中通入过量CO2:ClO-+H2O+CO2=HClO+HCO3-
B.向(NH4)2Fe(SO4)2溶液中加入少量NaOH溶液:NH4++OH-=NH3·H2O
C.用铜电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.向Na2S2O3溶液中滴加稀硫酸:S2O32-+2H+=S↓+SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,将0.5mol(NH4)2SO4溶于水中,向所得溶液中滴加aL氨水后溶液呈中性,据此判断下列说法中不正确的是( )
A.滴加氨水的过程中,水的电离平衡将正向移动
B.滴加aL氨水后的溶液中,n(NH4+)=200n(NH3·H2O)=1mol
C.所滴加氨水的浓度为![]() mol·L-1
mol·L-1
D.滴加aL氨水后的溶液中各离子浓度大小为c(NH4+)=2c(SO42-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发一种低成本的铝硫二次电池,以铝箔和多孔碳包裹的S为电极材料,离子液体为电解液。放电时,电池反应为2Al+3S=Al2S3,电极表面发生的变化如图所示。下列说法错误的是( )
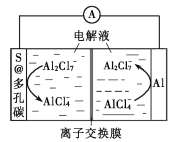
A.充电时,多孔碳电极连接电源的负极
B.充电时,阴极反应为8Al2Cl7-+6e-=2Al+14AlCl4-
C.放电时,溶液中离子的总数不变
D.放电时,正极增重0.54g,电路中通过0.06mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用结构和原理阐释化学反应的类型、限度、速率和历程是重要的化学学科思维。回答下列问题:
(1)用过氧化氢检验Cr(Ⅵ)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5结构式为![]() ,该反应是否为氧化还原反应?___(填“是”或“否”)。
,该反应是否为氧化还原反应?___(填“是”或“否”)。
(2)已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+O2(g)=H2O2(l) △H=-187.8kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) △H=___kJ·mol-1。
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。

①0-20min内,v(H2O2)=___。
②据图分析,n=___。
③其它条件相同,使用活性更高的催化剂,下列说法正确的是___(填标号)。
A.v(H2O2)增大 B.k增大 C.△H减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时![]() =___,Kp2=___。
=___,Kp2=___。
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将___(填“增加”“减少”或“不变”,下同),NaHCO3质量将___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池在生活巾应用广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
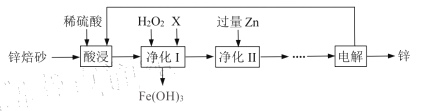
回答以下问题:
(1)ZnFe2O4中Fe的化合价是_______。
(2)为了提高酸浸效率,可采用的措施是_______(至少两条)。
(3)净化I的过程中温度不能太高,原因是________。
(4)X可以调节pH,则X为________。
(5)净化II中的离子反应方程式_______.
(6)本流程中可以循环利用的物质除锌外还有________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(g)+Y(g) ![]() 2Z(g)△H<0。一定条件下,反应物Y的转化率与反应时间的关系如图所示。若使曲线a变为曲线b可采取的措施是
2Z(g)△H<0。一定条件下,反应物Y的转化率与反应时间的关系如图所示。若使曲线a变为曲线b可采取的措施是
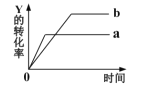
A.加入催化剂B.降低温度C.增大压强D.增大Y的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气的反应为C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )

A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
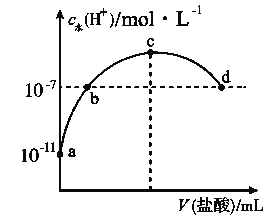
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com